微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将0.1mol·L-1醋酸溶液加水稀释,下列说法正确的是
[???? ]
A.溶液中c (H+)和c(OH-)都减小
B.溶液中c (H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大
参考答案:D
本题解析:
本题难度:一般
2、选择题 可以判定某酸HA是弱电解质的事实是
A.HA能与水以任意比互溶
B.0.1 mol·L-1HA溶液的pH约为3
C.HA可与NaHCO3反应放出CO2
D.HA溶液的导电能力很差
参考答案:B
本题解析:
试题分析:判断物质是弱电解质的依据是该物质部分电离,存在电离平衡。所以HA的水溶性与电离无关,A错误;0.1 mol·L-1HA溶液的pH约为3即c(H+)="0.001" mol·L-1 ,所以说明HA不完全电离,是弱酸,B正确;HA与NaHCO3反应放出CO2 只能说明酸性HA>H2CO3,但不能说明是弱酸,所以C错误;水溶液导电能力与溶液中的离子浓度有关,所以D错误,故选D。
本题难度:一般
3、选择题 金属单质靠电子导电,电解质靠离子导电.NaCl离子晶体的基本微粒就是离子,为什么它不能导电?下列说法中错误的是
A.离子的导电一定要在溶液中进行
B.它的离子不是自由离子
C.电离是电解质导电的前提
D.热量是破坏离子键的有效条件
参考答案:A
本题解析:分析:含有自由移动的电子或含有自由移动的阴阳离子的物质能导电,所以如果物质能导电则该物质一定含有自由移动的电子或离子,注意含有离子的物质不一定在水溶液里.
解答:A.离子的导电不一定要在溶液中进行,如熔融状态下的氯化钠中含有自由移动的离子,所以熔融态氯化钠能导电,故A错误;
B.氯化钠晶体中的阴阳离子不是自由离子,所以氯化钠晶体不导电,故B正确;
C.电解质电离才能生成自由移动的阴阳离子,所以电离是电解质导电的前提,故C正确;
D.化学键的断裂需要吸收能量,所以热量是破坏离子键的有效条件,故D正确;
故选A.
点评:本题考查物质导电的原因,易错选项是A,注意电解质的水溶液里或熔融状态下都含有自由离子,为易错点.
本题难度:困难
4、选择题 等质量的三份锌a、b和c,分别加入足量的稀硫酸中,a中同时加入适量CuSO4溶液,b中加入适量CH3COONa溶液,C中不加入其他物质.下列各图中表示其产生H2的总体积(V)与时间(t)的关系中正确的是( )
A.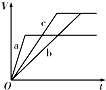
B.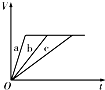
C.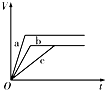
D.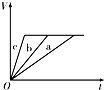
参考答案:锌和硫酸反应,加入硫酸铜,会置换出金属铜,形成锌、铜、稀硫酸
本题解析:
本题难度:简单
5、选择题 用均为0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中?c?(CH3COO-)>c?(Na+),对该混合溶液的下列判断正确的是( )
A.c?(OH-)>c?(H+)
B.c?(CH3COOH)+c?(CH3COO-?)=0.2?mol/L
C.c?(CH3COOH)>c?(CH3COO-?)
D.c?(CH3COO-?)+c?(OH-?)=0.2?mol/L
参考答案:A.CH3COOH和CH3COONa混合溶液中,存在c(Na
本题解析:
本题难度:简单