微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS)
B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大
C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体
D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀
参考答案:C
本题解析:
试题分析:A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),是因为难溶的向更难溶的转化。则Ksp(PbS)>Ksp(CuS)。错误。B.在NaHS溶液中,存在电离平衡:HS- H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,
H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,
本题难度:一般
2、选择题 超酸是指酸性比普通无机酸强l06~1010倍的酸,魔酸(HSO3F-SbF5)是已知超酸中最强的,许多物质如
H2SO4在魔酸中可获得质子。则硫酸溶于魔酸中所表现出的这种性质是[???? ]
A.碱性
B.酸性
C.还原性
D.氧化性
参考答案:A
本题解析:
本题难度:一般
3、选择题 将浓度为0.1mol?L-1HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+)
B.Ka(HF)
C.
c(F-)
c(H+)
D.c(H+)
c(HF)
参考答案:A、因HF为弱酸,则浓度为0.1mol?L-1HF溶液加水不
本题解析:
本题难度:简单
4、填空题 (4分)工业上用MnO2为原料制取KMnO4,主要生产过程分为两步进行:第一步将MnO2和KOH、粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,两极发生的电极反应式:
阴极是?????????????????,阳极是?????????????????;
电解的总反应方程式是??????????????????。
参考答案:
 本题解析: 本题解析:
由题意在阳极上得到KMnO4,在阴极上得到KOH,阴极是水的电离平衡被破坏,阴极:2H2O?+2e―=H2+2OH― ;阳极:MnO42――e―=MnO42―
总反应:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑
本题难度:一般
5、选择题 用蒸馏水稀释0.1 mol/L醋酸时,始终保持增大趋势的是????? ( )
A.溶液中的c(CH3COO-)
B.溶液中的c(H+)
C.醋酸的电离平衡常数
D.溶液中的c(OH-)
参考答案:D
本题解析:醋酸溶液存在如下电离平衡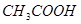 ? ? ;加水稀释,平衡向右移动,所以 ;加水稀释,平衡向右移动,所以
A错,加水稀释,溶液中的c(CH3C
本题难度:一般
|
|