微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在A+2B =3C+4D反应中,表示反应速率最快的数据是
[???? ]
A.v(A)=0.5 mol/(L·s)
B.v(B)=0.5 mol/(L·s)
C.v(C) =0.8 mol/( L·s)
D.v(D)=1.0 mol/(L·s)
参考答案:A
本题解析:
本题难度:简单
2、选择题 表示反应N2(g)+3H2(g)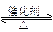 2NH3(g)(正反应为放热反应)在某一时间段内反应速率与反应过程的曲线关系图,则氨的体积分数最高的一段时间是(???)
2NH3(g)(正反应为放热反应)在某一时间段内反应速率与反应过程的曲线关系图,则氨的体积分数最高的一段时间是(???)

A.t0—t1
B.t2—t3
C.t3—t4
D.t5—t6
参考答案:A
本题解析:t1—t2时间段,平衡逆向移动;t3—t4时间段平衡不移动;t4—t5时间段,平衡逆向移动;故t0—t1时间段,NH3的百分含量最高。
本题难度:简单
3、选择题 反应4NH3(g) + 5O2(g) = 4NO(g)+ 6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)可表示为
A.v(NH3)=0.01mol/L/s
B.v(O2)=0.001mol/L/s
C.v(NO)=0.001mol/L/s
D.v(H2O)=0.045 mol/L/s
参考答案:C
本题解析:试题分析:半分钟后,水蒸气的物质的量增加了0.45mol,则水蒸气的反应速率是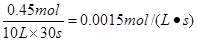 。又因为反应速率之比是相应的化学计量数之比,所以选项C正确。
。又因为反应速率之比是相应的化学计量数之比,所以选项C正确。
考点:考查反应速率的有关计算。
点评:在进行反应速率的有关计算时,除了根据概念之外。还需要依据反应速率之比是相应的化学计量数之比进行计算和判断。
本题难度:简单
4、填空题 在容积为2.0 L的密闭容器中充入0.60 mol X和1.60 mol Y,发生反应:aX(g)+3Y(g) 2Z(g) 经过10 min反应达到平衡状态,Y的浓度为0.2 mol/L,Z的物质的量分数为。计算并回答:
2Z(g) 经过10 min反应达到平衡状态,Y的浓度为0.2 mol/L,Z的物质的量分数为。计算并回答:
① 10分钟内,Z的平均反应速率为 _______________
② 计算a 的值(要求有具体过程)_____________
③ 该条件下X的平衡转化率_____________________(百分数表示,保留一位小数)
④ 该条件下反应2Z(g)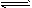 aX(g)+3Y(g)的平衡常数为___________
aX(g)+3Y(g)的平衡常数为___________
⑤ 将体积比为 1︰3的X和Y的混合气体,通入上述密闭容器中,在一定的条件下发生反应,达到化学平衡时,混合气体中A 的体积分数为w %(w < 25), 则混合气体中Z的体积分数是________,容器内的压强为反应前的_________ 倍。
参考答案:(1)0.04 mol/(L·min)
(2)a=1
本题解析:
本题难度:一般
5、选择题 对于在恒容密闭容器中、一定条件下进行的可逆反应N2(g)+3H2(g) 2NH3(g),能说明反应已达到平衡状态的是:(???)?
2NH3(g),能说明反应已达到平衡状态的是:(???)?
A.总压强保持不变
B.密度保持不变
C.各物质浓度相等
D.c(NH3)∶c(N2)∶c(H2)=2∶1∶3
参考答案:A
本题解析:
试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。根据方程式可知,反应是体积减小的可逆反应,因此压强也是减小的,所以选项A可以说明;平衡时各种物质的浓度不再发生变化,但各种物质的浓度之间不一定相等或满足某种关系,C和D都是错误的;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,B不正确,答案选A。
点评:判断化学平衡状态的标志有:(1)任何情况下均可作为标志的:①υ正=υ逆(同一种物质);②各组分含量(百分含量、物质的量、质量)不随时间变化;③某反应物的消耗(生成)速率、某生成物的消耗(生成)速率=化学计量数之比;(2)在一定条件下可作为标志的是:①对于有色物质参加或生成的可逆反应体系,颜色不再变化;②对于有气态物质参加或生成的可逆反应体系,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容);③对于恒温绝热体系,体系的温度不在变化;(3)不能作为判断标志的是:①各物质的物质的量或浓度变化或反应速率之比=化学计量数之比 (任何情况下均适用);②有气态物质参加或生成的反应,若反应前后气体的系数和相等,则混合气体平均相对分子质量M和反应总压P不变(恒温恒容)。
本题难度:一般