微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验能达到预期目的的是
编号
| 实验内容
| 实验目的
|
A
| 取两只试管,分别加入4ml 0.01mol/L KMnO4酸性溶液,然后向一只试管中加入0.1mol/L H2C2O4溶液2ml,向另一只试管中加入0.1mol/L H2C2O4溶液4ml,记录褪色时间。
| 可以证明H2C2O4浓度越大反应速率越快。
|
B
| 向1ml 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀。
| 可以证明在相同温度下,溶解度Mg(OH)2>Fe(OH)3
|
C
| 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大。
| 证明了非金属性S>C
|
D
| 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅。
| 可以证明Na2CO3溶液中存在水解平衡。
?
参考答案:D
本题解析:
试题分析:A、两只试管中草酸的浓度几乎是相同的,所以不能证明H2C2O4浓度越大反应速率越快,A不正确;B、由于氢氧化钠在和氯化镁溶液反应时氢氧化钠过量,所以再加入氯化铁时一定产生红褐色氢氧化铁沉淀,所以不能证明在相同温度下溶解度Mg(OH)2>Fe(OH)3,B不正确;S元素的最高价是+6价,因此应该测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,如果后者较大可以证明非金属性S>C,C不正确;D、向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色会变浅,这说明溶液中OH-浓
本题难度:一般
2、选择题 如图为铜锌原电池装置,下列叙述错误的是( )
A.Zn片为负极,Cu片为正极
B.Zn片上发生氧化反应
C.Cu片上发生氧化反应
D.Cu?片上有气泡产生
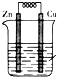
参考答案:A.该原电池中,较活泼的金属锌作负极,铜作正极,故A正确;<
本题解析:
本题难度:简单
3、选择题 如下图所示装置,能够组成原电池且产生电流的是( )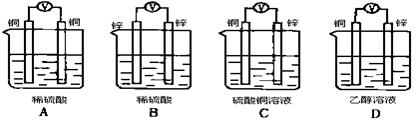
参考答案:C
本题解析:略
本题难度:一般
4、选择题 关于原电池的叙述中正确的是?????????????????????????????????????????
A.构成原电池的电极是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.原电池负极发生的电极反应是还原反应
D.原电池的正极是还原剂,总是溶液中的阳 离子在此被还原 离子在此被还原
参考答案:B
本题解析:略
本题难度:简单
5、选择题 下列关于原电池的叙述中,正确的是(???)
A.把电能转化为化学能,使溶液发生氧化还原反应
B.电子从活泼金属流向不活泼金属,不活泼金属为负极
C.外电路中电子从负极流向正极
D.正极发生氧化反应
参考答案:C
本题解析:
试题分析:A.原电池把化学能转化为电能,使溶液发生氧化还原反应,原说法不正确;B.电子从活泼金属流向不活泼金属,活泼金属为负极,原说法不正确;C.外电路中电子从负极流向正极,正确;D.正极发生还原反应,原说法不正确。
本题难度:简单
|