微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:
2CO(g)+O2(g)=2CO2(g)???ΔH=-566?kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)?? ΔH=-226?kJ/mol
根据以上热化学方程式判断,下列说法正确的是
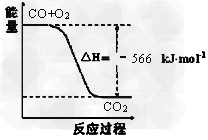 [???? ]
[???? ]
A、CO的燃烧热为283?kJ
B、上图可表示由CO生成CO2的反应过程和能量关系
C、2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)????ΔH>-452?kJ/mol
D、CO(g)与Na2O2(s)反应放出509?kJ热量时,电子转移数为1.204×1024
参考答案:CD
本题解析:
本题难度:一般
2、填空题 (4分)现有电解质溶液:①Na2CO3?②NaHCO3?③CH3COONa?④ NaOH
(1)当四种溶液的pH相同时,其物质的量浓度由大到小的顺序是?????????????????(填编号,以下相同)
(2)在上述四种电解质溶液中,分别加入AlCl3溶液,无气体产生的是?????????????
参考答案:4分(每空2分共4分)
(1)?③②①④????(2)
本题解析:略
本题难度:一般
3、选择题 室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,
下列说法正确的是(??)
A.起始时盐酸和醋酸溶液PH相同
B.V(NaOH)=10.00 mL 时,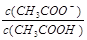 <1
<1
C.pH=7时,两种酸所用NaOH溶液体积不相等,醋酸用的体积多
D.V(NaOH)="20" .00 mL 时,c(Cl?)>c(CH3COO—)
参考答案:D
本题解析:
试题分析:A.盐酸和醋酸溶液的物质的量浓度相同,但是由于HCl是强酸,完全电离,CH3COOH是弱酸,部分电离,起始时盐酸和醋酸溶液PH不相同。错误。B.V(NaOH)=10.00 mL 时溶液为CH3COOH和CH3COONa等浓度的混合溶液。溶液中由于CH3COOH的电离作用大于CH3COO-的水解作用,所以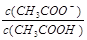 本题难度:一般
本题难度:一般
4、选择题 物质的量浓度相同的下列各溶液,由水电离出的c(H+)由大到小的顺序是
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②①
B.①②③④
C.③②④①
D.③④②①
参考答案:C
本题解析:
试题分析:水是弱电解质,电离方程式是H2O H++OH-。所以酸或碱是抑制水的电离平衡的,能够水解的盐是促进水的电离的。据此可知,硫酸氢钠抑制水的电离,碳酸氢钠和碳酸钠水解促进水的电离,但碳酸钠的水解程度大于碳酸氢钠的。硫酸钠不水解,既不促进,也不抑制,所以由水电离出的c(H+)由大到小的顺
H++OH-。所以酸或碱是抑制水的电离平衡的,能够水解的盐是促进水的电离的。据此可知,硫酸氢钠抑制水的电离,碳酸氢钠和碳酸钠水解促进水的电离,但碳酸钠的水解程度大于碳酸氢钠的。硫酸钠不水解,既不促进,也不抑制,所以由水电离出的c(H+)由大到小的顺
本题难度:一般
5、选择题 下列热化学方程式中△H表示可燃物燃烧热的是[???? ]
A.C(s) + 1/2O2(g) = CO(g) △H= -110.5 kJ/mol
B.2H2(g) + O2(g) = 2H2O(l) △H= -571.6kJ/mol
C.CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H= -802.3kJ/mol
D.CO(g) + 1/2O2(g) = CO2(g) △H= -283.0kJ/mol
参考答案:D
本题解析:
本题难度:简单