阴离子
| S 、OH- 、OH-
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:

(1) M为直流电源的???极,b电极上发生的电极反应为????????????。
(2)计算e电极上生成的气体在标准状况下的体积为???????????。
(3)写出乙烧杯中的总反应的离子方程式:???????????????????。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)?????????????。
参考答案:(1)负 4OH--4e-=2H2O+O2↑
(2)5
本题解析:乙中c电极质量增加了16 g,说明c电极上有铜析出,所以c电极是阴极,则M是负极。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示,甲溶液pH增大,所以甲中盛放的只能是碱,乙中pH降低且有铜生成,说明该溶液是硫酸铜溶液,丙中溶液的pH不变,说明电解的是水且溶液的浓度增大对其pH无影响,所以是强酸强碱盐。(1)M是负极,则b是阳极,阳极上氢氧根离子失电子生成水和氧气,所以电极反应式为4OH--4e-=2H2O+O2↑。(2)e是阴极,e上氢离子得电子生成氢气,根据转移电子数相同

本题难度:一般
4、选择题 在如图所示装置中,通电后可观察到Cu极溶解,则下列说法中不正确的是
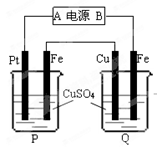
A.直流电源中,A是正极
B.两池内CuSO4溶液浓度均不改变
C.两个铁电极上最初析出物质相同
D.P池内溶液的质量逐渐减小
参考答案:B
本题解析:
试题分析:通电后可观察到Cu极溶解,可知Q池中Cu极是阳极,Fe极是?阴极,则A是正极,B是负极,P池中Pt阳极,Fe极是阴极,两个铁电极上最初析出物质都是铜,P池中CuSO4溶液浓度减小,溶液的质量逐渐减小[;Q池中CuSO4溶液浓度不变,溶液的质量不变。综上所述,B错误,ACD正确。
本题难度:一般
5、实验题 (12分)氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是???????????????????;
(2)电解饱和食盐水的离子方程式是??????????????????????????????;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用??????????????;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来自电解池):
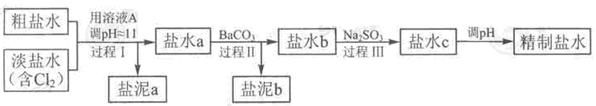
①盐泥a除泥沙外,还含有的物质是????。
②过程Ⅰ中将NH4+转化为N2的离子方程式是???
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有??????
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3盐水b ,至多添加10% Na2SO3溶液???????kg(溶液体积变化忽略不计)。
参考答案:(12分,除(1)和①每空1分外,其余每空2分)
(1
本题解析:略
本题难度:简单
|