微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)已知A、B、C、D四种溶液分别为NaHCO3、Ca(OH)2、FeCl3、HCl,它们相互之间的反应现象如下表所示,其中“↓”表示有沉淀生成,“↑”表示有气体生成,“-”表示无现象。
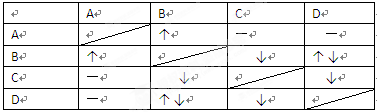
(1)写出B的化学式????????????,D的化学式?????????????????。
(2)写出B+C(过量)反应的离子方程式????????????????。
参考答案:(1)NaHCO3(2分)??? FeCl3(2分)
本题解析:由于碳酸氢钠和氯化铁水解相互促进,生成氢氧化铁和CO2,与盐酸反应生成CO2,和氢氧化钙反应也生成沉淀,所以根据现象可知,B一定是碳酸氢钠,A是盐酸,C是氢氧化钙,D是氯化铁。如果氢氧化钙过量,则氢氧化钙和碳酸氢钠反应生成物是碳酸钙、氢氧化钠和水,方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O。
本题难度:一般
2、选择题 下列各组离子在溶液中能大量共存的是
A.Cu2+、C1—、Na+
B.H+、Cl—、CO32—
C.Ba2+、Na+、SO42—
D.H+、K+、OH—
参考答案:A
本题解析:
试题分析:B项:H+、、CO32—反应生成二氧化碳和水,不能共存,故错;C项:Ba2+、SO42—反应生成沉淀,不能共存,故错;D项:H+、、OH—反应生成水,不能共存,故错。故选A。
点评:本题考查的是离子共存的知识,题目难度不大,复分解反应其实是离子间的反应,离子间不能形成水、气体或沉淀,离子可以共存。
本题难度:简单
3、选择题 某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是
A.Mg2+、Cl-、Na+、NO3-
B.K+、Na+、NO3-、HCO3-
C.Na+、Ba2+、Cl-、NO3-
D.Fe3+、Na+、AlO2-、SO42-
参考答案:C
本题解析:能溶解Al(OH)3的溶液可能是酸溶液,也可能是碱溶液,所以:
A不能,在碱溶液中镁离子不能存在.
B不能,在酸或者碱溶液中,碳酸氢根离子都不能存在.
C可以.
D不能,在酸溶液中,偏铝酸根离子不能存在,在碱溶液中,铁离子不能存在.
本题难度:困难
4、选择题 某100 mL溶液中含H2SO40.50? mol,加入下列物质,溶液导电性增强的是
A.0.50molBa(OH)2
B.100mL水
C.0.50mol酒精
D.0.50molNa2SO4
参考答案:D
本题解析:A选项与H2SO4恰好完全反应,生成水和沉淀,溶液不导电:H2SO4+Ba(OH)2=BaSO4↓+2H2O;B选项溶液的体积扩大为原来的2倍,c(H+)和c( ),都变为原来的1/2,溶液的导电性减弱;C选项酒精是非电解质,溶解在水中,扩大了溶液的体积,降低了H+、
),都变为原来的1/2,溶液的导电性减弱;C选项酒精是非电解质,溶解在水中,扩大了溶液的体积,降低了H+、![]() 的浓度,溶液导电性减弱;D选项增加了离子的总浓度,溶液的导电性增强。
的浓度,溶液导电性减弱;D选项增加了离子的总浓度,溶液的导电性增强。
本题难度:简单
5、填空题 氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是________mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_________________________________________________________________。
参考答案:(1)14HNO3(稀)+3Cu2O=6Cu(NO3)2+2
本题解析:(1)从所给还原过程的反应式看NO3-得电子,即HNO3作氧化剂,要能使该反应发生必须加入还原剂,因此甲只能是Cu2O。(3)若产生0.2 mol气体(NO),则转移的电子物质的量为(5-2)×0.2 mol=0.6 mol。(4)若1 mol甲与某浓度硝酸反应时,被还原的硝酸的物质的量增加,根据电子得失守恒推知,可能是使用了较浓的硝酸,使产物中生成了部分NO2。
本题难度:一般