微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现代生产、生活和国防中大量使用电池。下列有关电池的说法正确的是
A.碱性锌锰电池性能好于普通电池的原因是能反复使用
B.碱性锌锰电池的正极是MnO2,当电池中有6.5g Zn反应时,将产生0.2molMnOOH
C.铅蓄电池放电时,负极的质量减少
D.使用碱性电解质的氢氧燃料电池,负极的电极反应是H2 - 2e- = 2H+
参考答案:B
本题解析:
试题分析:碱性锌锰电池和普通电池都是一次电池,不能反复使用,A错误;碱性锌锰电池总反应是Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH )~2e-,当消耗1molZn时,生成2molMnO(OH),B正确;铅蓄电池放电时,负极反应为Pb-2e-+SO42-=PbSO4,质量增加,C错误;碱性氢氧燃料电池,负极电极反应式为H2-2e-+2OH-=2H2O,D错误。
点评:书写原电池电极反应要注意介质,注意负极生成的离子与溶液中阴离子是否共存。同时注意正负极反应式相加得到原电池总反应
本题难度:一般
2、选择题 如下图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是(??? )
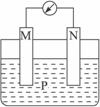
?
| M
| N
| P
|
A
| 锌
| 铜
| 稀硫酸溶液
|
B
| 铜
| 铁
| 稀盐酸
|
C
| 银
| 锌
| 硝酸银溶液
|
D
| 锌
| 铁
| 硝酸铁溶液
参考答案:C
本题解析:A选项可组成原电池,其中M溶解变细,N棒上有气泡产生;B选项组成的原电池中,N变细,M棒上有气泡产生;D选项组成的原电池中,M变细,N变粗。
本题难度:一般
3、选择题 下列说法正确的是
A.常温下能够进行的化学反应都是放热反应,高温下进行的反应都是吸热反应
B.常温常压下,pH = 1的盐酸中约含有6.02×1023个氢离子
C.常温常压下,0.5mol氮气和氢气的混合气体体积大于11.2L
D.原电池装置的正、负极可以是同一种金属
参考答案:CD
本题解析:A不正确,反应是放热反应还是吸热反应,与反应条件无关系,只与反应物和生成物总能量的相对大小有关系;B中溶液的体积无法确定,因此不能计算氢离子的物质的量,B不正确;根据PV=nTR可知,在压强不变时,气体体积随温度的升高而增大,C正确;D正确,例如燃料电池等,答案选CD。
本题难度:一般
4、选择题 根据图示判断下列叙述符合事实的是( )
A.
连接好并放置片刻后,铁片会镀上一层铜
B.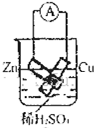
连接好导线后(片与片相接触),电流表会发生明显偏转
C.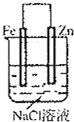
连接好并放置片刻后,在Zn片附近加一滴酚酞溶液,溶液变为红色
D.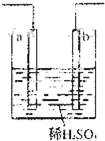
发生反应为Fe+2H+═Fe2++H2↑时,a、b可能是同种材料的电板
参考答案:A.电镀时,镀层作阳极、镀件作阴极,所以铁片上镀铜时,铜作阳
本题解析:
本题难度:简单
5、选择题 在常温常压下,某实验小组按下图做完实验后,实验报告记录如下。其中描述合理的是
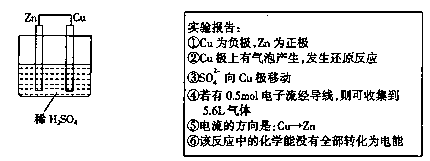
A.①②③
B.②③④
C.②⑤⑥
D.③④⑥
参考答案:C
本题解析:
试题分析:①该装置构成了原电池。由于金属活动性Zn>Cu,所以Zn作负极,Cu作正极,错误;②在正极上溶液中的H+得到电子,被还原变为H2,故Cu电极上有气泡产生,发生还原反应,正确;③根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的SO42-会向正电荷较多的负极Zn电极移动,错误;④n(e-)=0.5mol,则根据整个电路中电子转移守恒可知n(H2)= 0.5mol÷2=0.25mol,则在标准状况下,产生氢气的体积 V(H2)= 0.25mol×22.4L/mol=5.6L,但是由于没有指明反应条件,所以不能确定氢气的体积多少,错误;⑤电子从负极Zn流向正极Cu,而电流则是从正极Cu流向负极Zn,正确;⑥在反应过程中反应的化学能大多数转化为电能,还有一部分转化为热能,因此反应过程中反应的化学能没有全部转化为电能,正确。因此正确的说法是②⑤⑥,选项是C。
考点:考查原电池飞反应原理的应用的知识。
本题难度:一般
|