??△??
.
?
CuSO4+SO2↑+2H2O
D.制CuSO4:2Cu+O2=2CuO;CuO+H2SO4(稀)=CuSO4+H2O
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列化工生产原理错误的是(???)
①可以用电解熔融的氯化钠的方法来制取金属钠②可以用钠加入氯化镁饱和溶液中制取镁③用电解法制铝时,原料是氯化铝④炼铁高炉中所发生的反应都是放热的,故无需加热
A.②③
B.①③
C.①②③
D.②③④
参考答案:D
本题解析:钠、镁、铝都是活泼的金属,冶炼都需要电解。①正确,②不正确,钠极易和水反应,应该电解熔融的氯化镁。氯化铝是共价化合物,熔融时不导电,③不正确。反应是放热反应,但并不意味着反应不需要加热,④不正确。答案选D。
本题难度:简单
3、填空题 .(21分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  ?2NH3(g)??△H= -92.4KJ/mol??,据此回答以下问题:
?2NH3(g)??△H= -92.4KJ/mol??,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)?????????。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应的活化能降低,加快反应速率
d.活化分子间所发生的碰撞为有效碰撞
e.降低温度,V正、V逆均减小且V正减小的倍数小于V逆减小的倍数。
f.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡影响规律知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是???????????????(填字母)。
a.容器内的密度保持不变??????????????
b.容器内压强保持不变????
c.υ正(N2)=2υ逆(NH3)????????????
d.混合气体中c(NH3)不变
e.容器内混合气体的平均摩尔质量保持不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
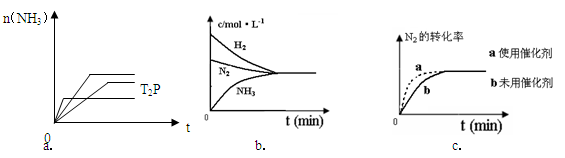
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
参考答案:(1)a、c、f、e、??(4分)
(2)①![]()
本题解析:(1)增大压强能增大单位体积内活化分子百分数,所以能增大反应速率,b不正确。活化分子间所发生的碰撞不一定都是有效碰撞,把能够发生化学变化的碰撞称为有些碰撞,d不正确,其余都是正确的,答案选acef。
(2)①平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度幂之积的比值,所以表达式为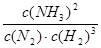 本题难度:一般
本题难度:一般
4、选择题 在硫酸的工业制法中,下列生产操作及对采取此操作的主要原因的叙述都正确的是()
A.硫铁矿燃烧前需要粉碎,因为大块的不能在空气燃烧
B.沸腾炉出来的炉气需净化,因为其中的SO2会与杂质反应
C.SO2氧化为SO3时,使用催化剂可以提高硫酸的产率
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以使SO3吸收完全
参考答案:D
本题解析:
试题分析:硫铁矿燃烧前需要粉碎的目的是增大反应物的接触面积,加快反应速率,A不正确;B不正确,杂质能使催化剂中毒,B不正确;催化剂不能改变平衡状态,所以C不正确,因此正确的答案选D。
点评:化工生产是以化学反应原理为依据,以实验室研究为基础,任何生成的完成都要符合化学反应规律。
本题难度:一般
5、填空题 【化学--选修2化学与技术】(15分)
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
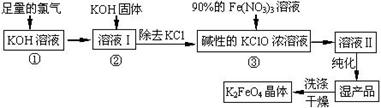
已知:2KOH + Cl2 ═ KCl + KClO + H2O(条件:温度较低)
? 6KOH + 3Cl2 ═ 5KCl + KClO3 + 3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺反应①应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体( 该溶液的密度为1.47 g/mL),它
的物质的量浓度为 ;
(5)在“溶液I”中加KOH固体的目的是 :
A.与 “溶液I” 中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,还会有副产品 (写化学式),它们都是重要的化工 产??品,具体说出其中一种物质的用途 (答1点即可); 则反应③中发生的离子反应方程式为????????????????????????????????????????。
(7)如何判断K2FeO4晶体已经洗涤干净??????????????????????????????。
参考答案:(15分)
(1)温度较低?(1分)
(2)2N
本题解析:
试题分析:(1)该生产工艺反应①应在较低温度下进行,因为后面会用到KClO溶液;
(2)工业上制取Cl2,是通过电解饱和食盐水的方法,化学方程式为2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑;
2NaOH + H2↑ + Cl2↑;
(3)K2FeO4具有强氧化性的原因是Fe元素的化合价显+6价,易得电子,具有
本题难度:一般