微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在HAc H++Ac-的电离平衡中,要使电离平衡向左移动,应采取的措施是(???)
H++Ac-的电离平衡中,要使电离平衡向左移动,应采取的措施是(???)
A.加HAc
B.加NaAc
C.加水
D.加NaOH
参考答案:B
本题解析:略
本题难度:简单
2、选择题 室温下,对于醋酸及其盐的下列判断正确的是

A.稀醋酸溶解石灰石的离子方程式为
CaCO3+2H+=Ca2++H2O+CO2↑
B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大
C.向稀醋酸中加入等浓度的NaOH溶液,导电能力变化如右图
D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同
参考答案:B
本题解析:
试题分析:醋酸是弱酸,电离方程式中应写出化学式,故A错误;醋酸是弱电解质,氢氧化钠和醋酸反应生成醋酸钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故C错误;CH3COONH4是弱酸弱碱盐,促进水的电离,醋酸根和铵根离子水解程度相同,故溶液显中性,K2SO4是强酸强碱盐,对水的电离程度没有影响,故D错误。
本题难度:一般
3、填空题 硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4- H++SO42-.
H++SO42-.
请据此回答下列有关问题:
(1)Na2SO4溶液呈?????????(填“弱酸性”、“中性”或“弱碱性”),原因是:???????(用离子方程式表示)
(2)写出H2SO4溶液与BaCl2溶液反应的离子方程式:??????????????????;
(3)在0.1 mol·L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是?????。(填编号)???????????
A.c(SO42-)+c(HSO4-)=0.1 mol·L-1
B.c(SO42-)+c(HSO4-)=2 c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(4)已知0.1 mol·L-1的NaHSO4溶液的pH=2,则0.1 mol·L-1的H2SO4溶液中SO42-的浓度????0.01mol·L-1(填“>” “="”" 或“<”)。
参考答案:(1)弱碱性 ;SO42-+H2O  本题解析:
本题解析:
试题分析:硫酸的第一步电离是完全的:H2SO4=H++HSO4-,第二步电离并不完全:HSO4- H++SO42-.(1)根据题给信息Na2SO4溶液存在SO42-的水解平衡:SO42-+H2O
H++SO42-.(1)根据题给信息Na2SO4溶液存在SO42-的水解平衡:SO42-+H2O 本题难度:一般
本题难度:一般
4、填空题 (8分)SO2、NO是大气污染物。工业上吸收SO2和NO,同时获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
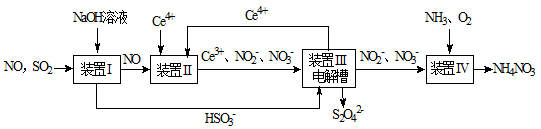
(1)装置Ⅰ中生成HSO3-的离子方程式为 ;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: ;
(3)装置Ⅲ中,电解槽的阳极发生的电极反应为 ;
(4)从装置Ⅳ中获得粗产品NH4NO3的实验操作依次为 、 、过滤、洗涤等。
参考答案:(8分)
(1)SO2 + OH-="=" HSO3-
本题解析:
试题分析:(1)过量的二氧化硫与氢氧化钠溶液反应生成亚硫酸氢根离子,离子方程式为SO2 + OH-="=" HSO3-;
(2)向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,是因为亚硫酸氢钠溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="=" CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="=" CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
(3)根据流程图可知,装置III电解槽中的硝酸根离子、亚硝酸根离子未变化,亚硫酸氢根离子变为S2O42-,S的化合价降低,Ce3+变为Ce4+,Ce的化合价升高,所以阳极发生的反应是Ce3+ - e— ="=" Ce4+;
(4)从溶液中得到晶体的操作是蒸发浓缩、冷却结晶,然后过滤、洗涤得到产品。
考点:考查对流程图的分析,溶液中的平衡应用,电化学反应原理,基本操作的判断
本题难度:困难
5、选择题 分别用pH=2和pH=3的醋酸溶液中和等物质的量的苛性钾溶液,消耗两种醋酸溶液的体积分别为V1和V2,V1和V2的关系正确的是( )
A.V2=10V1
B.V1>10V2
C.V2<10V1
D.V2>10V1
参考答案:设pH=2的醋酸浓度为c1,pH=3的醋酸浓度为c2,醋酸的
本题解析:
本题难度:简单