微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L?s)
B.将容器体积变为20L,Z的平衡浓度变为原来的
1
2
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y?的浓度相等
参考答案:2X(g)+Y(g)?Z(g),
开始1mol????
本题解析:
本题难度:一般
2、计算题 将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2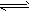 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率? 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
参考答案:35.2%
本题解析:
本题难度:一般
3、选择题 一定温度下,在2L的密闭容器中加入4mol A和6mol B,发生如下反应:
2A(g)+3B(g) 4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是???????????????????????????????????????????????????????? 4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是????????????????????????????????????????????????????????
A、前10min反应的平均速率V(C)=0.10mol/L·min
B、10min后向容器中加入A,重新平衡时 A的转化率一定大于50% A的转化率一定大于50%
C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L
D、反应达平衡时B的平衡浓度是1.5mol/L
参考答案:D
本题解析:达平衡时D的浓度为0.5mol/L,故用D表示的反应速率是V(D)=0.050mol/L·min,故V(C)=0.20mol/L·min,故A错;此反应为等体反应,加压平衡不移动,故10min后向容器中加入A,重新平衡时 A的转化率一定等于50%,恒温下将反应容器体积缩小一半,则D的平衡浓度等于1.0mol/L,所以B、C错误;D对。 A的转化率一定等于50%,恒温下将反应容器体积缩小一半,则D的平衡浓度等于1.0mol/L,所以B、C错误;D对。
本题难度:一般
4、选择题 对可逆反应 4N3(g )+5O2 ( g) 4NO(g)+ 6H2O ( g ) ,下列叙述正确的是 4NO(g)+ 6H2O ( g ) ,下列叙述正确的是
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的
n (NH3 ) : n (O 2 ) =" 4:5"
B.反应达到平衡后,对体系一直进行加压,平衡总是向逆向移动
C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动
D.当v正(NH3 ) : v正(NO)=" l" : 1 时,说明该化学反应已经达到平衡
参考答案:A
本题解析:平衡时,反应物的转化率相等,则起始投人量之比应该等于化学计量数之比,故 A 正确;当加压到一定压强时,气态水变为非气态,平衡会向正向移动,故 B 也错;充入稀有气体而压强不变,相当于增大容积,平衡向体积增大方向移动,C 错; NH3、NO的正反应速率都是向右方向的速率,平衡与否其反应速率之比都等于化学计量数之比,故 D 错。选A 。
本题难度:一般
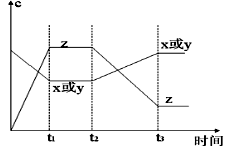
5、选择题 今有X(g)+Y(g) 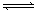 2Z(g)??△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的(?) 2Z(g)??△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的(?)
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
参考答案:D
本题解析:根据图像可知,从t2→t3的曲线变化是反应物的浓度逐渐增大,而生成物的浓度逐渐减小,这说明平衡向逆反应方向进行。由于反应前后体积不变,所以改变压强平衡不移动。正反应是放热反应,所以改变的条件是升高温度,平衡向逆反应方向移动,答案选D。
本题难度:一般
|