微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在100℃时,将0.200 mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格
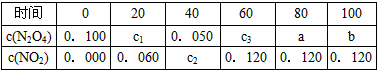
试填空:
(1)该反应的化学方程式为_____________________________,达到平衡时四氧化二氮的转化率为
________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为
________mol·L-1·s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol·L-1。
参考答案:(1)N2O4(g)![]() 本题解析:
本题解析:
本题难度:一般
2、选择题 下列能表明可逆反应: A +2B 2C 已达平衡状态的的是
2C 已达平衡状态的的是
A.?? A、B、C的浓度相等
B.??当生成1molA的同时也生2molB
C.?? A、B、C的物质的量比为1:2:2
D.??当生成1molA的同时也生成2molC
参考答案:D
本题解析:A 错误,已达平衡状态时,各物质的浓度不在发生变化,不一定相等
B 错误,放应方向都是向左的
C 错误,平衡时各物质的量不一定等于各物质的化学计量数之比
D 正确,正反应速率等于逆反应速率,反应达到平衡
本题难度:一般
3、填空题 在一定温度下,发生如下反应:N2(g)+3H2(g)  2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,平衡时生成NH3的物质的量是2.4 mol。已知容器的容积为5.0 L,试求:
2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0 mol和6.0 mol,平衡时生成NH3的物质的量是2.4 mol。已知容器的容积为5.0 L,试求:
(1)H2的转化率是________。
(2)平衡时混合气体中N2的体积分数是________。
参考答案:(1)60% (2)27.3%
本题解析:
N2 + 3H2  ?2NH3
?2NH3
起始? 3.0 mol???? 6.0 mol????? 0 mol
转化? 1.2 mol???? 3.6 mol????? 2.4 mol
平衡? 1.8 mol???? 2.4 mol????? 2.4 mol
(1)H2的转化率=3.6/6.0×100%=60%。
(2)N2的体积分数= ×100%≈27.3%。
×100%≈27.3%。
本题难度:一般
4、选择题 mA(g)+nB(g)?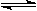 pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是(??)
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是(??)
①体系的压强不再改变??②绝热体系的温度不再改变??③各组分的浓度不再改变
④各组分的质量分数不再改变?⑤反应速率vA:?vB:?vC:?vD = m:n:p:q
⑥单位时间内m mol A断键反应,同时p mol C也断键反应?????
A.③④⑤⑥
B.②③④⑥
C.①③④⑤
D.①③④⑥
参考答案:B
本题解析:
试题分析:①若该反应是反应前后气体体积相等的反应,则无论反应是否达到平衡,体系的压强都不会改变。因此不能作为判断反应是否达到平衡的标志。错误。?②任何反应发生的过程都伴随热量变化,若绝热体系的温度不再改变,则正向进行的程度与逆向进行的程度相同,反应达到平衡状态。因此可以作为判断反应达到偏高的标志。正确。③因为反应物、生成物的状态都是气态。若各组分的浓度不再改变,说明正反应速率与逆反应速率相同。反应达到平衡状态。正确。④各组分的质量分数不再改变?,说明任何物质的物质的量不变,浓度不变,正反应速率与逆反应速率都相同,反应达到平衡状态。正确。⑤在任何时刻反应混合物中各物质的反应速率vA:?vB:?vC:?vD =m:n:p:q。因此不能作为判断反应达到平衡状态的标志。错误。⑥单位时间内m mol A断键反应,就会有pmol的C键形成,同时p mol C也断键反应???;即C的物质的量不变。由于反应混合物都是气态,所以任何物质的物质的量不变,因此反应达到平衡状态。正确。故??达到平衡的标志是②③④⑥。选项是B。
本题难度:一般
5、选择题 在一定温度下A(气)+3B(气)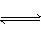 2C(气)达平衡的标志是( )
2C(气)达平衡的标志是( )
A.物质A、B、C的分子个数比为1:3:2
B.单位时间内生成A、C的物质的量之比为1:2
C.单位时间内生成A、B的物质的量之比为1:3
D.反应速率
参考答案:B
本题解析:判断化学反应达到平衡状态的依据是:(1)υ正=υ逆,(2)反应混合物中各组分的百分含量保持不变。本题选项凡假设开始投入2molA和6molB进行反应,当达到平衡状态选项B中A的生成速率是逆反应速率,C的生成速率是正反应速率,两者的比例关系恰恰说明正逆反应速率相等;选项C中A、B的生成速率均表示逆反应速率,没有表达正逆反应速率的关系;选项D没有指明反应速率是正反应速率还是逆反应速率。
本题难度:简单