微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (9分)实验室中用右图装置制取氯气:
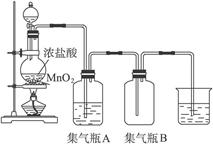
试完成下列问题:
(1)该反应是氧化还原反应吗?___________,如果是氧化还原反应,请指出___________是氧化剂,___________是还原剂,写出该反应的离子方程式______________________________。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是______________________________________________。
(3)氯气溶于水显酸性,且氯气有毒,并有强烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用____________________溶液来吸收有毒的氯气。
参考答案:(1)是? MnO2?浓盐酸? 4H++2Cl-+MnO2<
本题解析:由实验室氯气的制取化学反应方程式4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O,根据MnO2中锰元素的化合价降低确定为氧化剂。利用氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度很大来除去Cl2中的HCl杂质。用NaOH溶液吸收少量的尾气Cl2,发生反应如下:Cl2+2NaOH====NaCl+NaClO+H2O。
Cl2↑+MnCl2+2H2O,根据MnO2中锰元素的化合价降低确定为氧化剂。利用氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度很大来除去Cl2中的HCl杂质。用NaOH溶液吸收少量的尾气Cl2,发生反应如下:Cl2+2NaOH====NaCl+NaClO+H2O。
本题难度:简单
2、选择题 下列实验设计方法正确的是
A.向卤代烃加硝酸酸化的硝酸银来检验其中的卤族素元素
B.实验用NH4Cl固体受热分解来制备NH3
C.用盐酸和澄清石灰水来检验某物质是否含有CO32-
D.可用下图所示的装置和药品来研究反应物浓度对反应速率的影响

参考答案:D
本题解析:
试题分析:A. 在卤代烃中卤素是以原子的形式存在的。检验的方法是将卤代烃与NaOH水溶液共热,然后加入硝酸酸化,再加硝酸银来检验其中的卤族素元素。错误。B. 在实验用NH4Cl固体与碱共热来制备NH3。错误。C. 向某物质中加入盐酸,若产生无色、无味能使澄清石灰水变浑浊的气体,就证明原物质中含有CO32-或HCO3-。错误。D.若硫酸的浓度大,在在相同的时间内产生氢气的体积大,若浓度小,产生的氢气的体积小。因此可用如图所示的装置和药品来研究反应物浓度对反应速率的影响。正确。
本题难度:一般
3、选择题 (20分)已知某化工厂的含镍催化剂主要含有Ni,还含有Al (31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。某校化学研究性学习小组通过查阅资料,设计了如下图所示的方法以该含镍废催化剂为原料来制备NiSO4·7H2O。
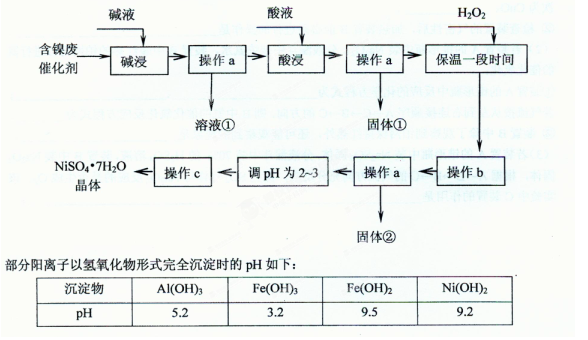
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为?????????。
(2)“碱浸”的目的是除去?????????。
(3)“酸浸”时所加入的酸是?????????(填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是?????????。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是?????????。
(5)“调pH为2~3“的目的是?????????。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是?????????。
(7) NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式___?????????。
(8)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积?????????和可逆反应Fe2++ 2H2O 2H++ Fe(OH)2在25℃时的平衡常数?????????
2H++ Fe(OH)2在25℃时的平衡常数?????????
参考答案:
 本题解析:(1)操作a、操作c为过滤,所以还缺少主要仪器是漏斗
本题解析:(1)操作a、操作c为过滤,所以还缺少主要仪器是漏斗
(2)含镍废催化剂中的AL、AL2O3能与碱液反应,其他成分不能与碱液反应。
(3)“酸浸”时所加入的酸是:稀硫酸,因为NiSO4·7H2O中含有硫酸根。
含镍废催化剂经碱液处理后,除去了AL、AL2O3,余下的成分主要为Ni,Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%),酸浸后,Ni,Fe(1.3%)的单质及氧化物能溶于硫酸,滤液中的金属离子是Ni2+、Fe2+离子;
(4)由于Fe2+离子氧化为Fe3+离子,所以调节溶液的pH最佳调控范围是3.2~9.2;
(5)Ni2+为弱碱阳离子,调pH为2~3的目的是抑制Ni2+的水解。
(6)可能是过氧化氢的量不足,导致e2+离子未被完全氧化造成的。
(7)由题信息得离子反应方程式为:2Ni2++CLO-+4OH-=2NiOOH+CL-+H2O;
(8)利用溶度积常数的计算方法处理计算。
本题难度:一般
4、实验题 氧化亚铜是大型水面舰船防护涂层的重要原料。某小组进行如下研究,请填写下列空白。
实验1:氧化亚铜的制取氧化亚铜可用葡萄糖和新制氢氧化铜悬浊液反应制取。文献表明,条件控制不当时会有少量CuO生成。
(1)实验室制取氢氧化铜悬浊液的离子方程式为____________。
(2)实验室用此方法制取并获得少量氧化亚铜固体,需要的玻璃仪器有试管、酒精灯、烧杯____________和____________。
(3)若要探究该反应发生的最低温度,应选用的加热方式为____________。
实验2:测定氧化亚铜的纯度
方案1:称取实验1所得固体m g,采用如下装置进行实验。
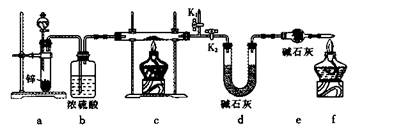
(4)装置a中所加的酸是____________(填化学式)。
(5)通过测出下列物理量,能达到实验目的的是____________。
A.反应前后装置a的质量
B.装置c充分反应后所得固体的质量
C.反应前后装置d的质量
D.反应前后装置e的质量
(6)在氢气验纯后,点燃装置c中酒精灯之前需要对K1、K2进行的操作是??____________
方案2:将实验l所得固体mg溶于足量稀硫酸,经过滤、洗涤、干燥后称出不溶物的质量(资料:Cu2O+2H+=Cu2++Cu+H2O)
(7)判断经干燥器干燥后的不溶物是否巳完全干燥的操作方法是__________________________________。
(8)若实验所得不溶物为ng,则该样品中氧化亚铜的质量分数为________________。
参考答案:(1)Cu2++2OH—=Cu(OH)2↓(2分)
(
本题解析:
试题分析:(1)实验室常用可溶性铜盐溶液与氢氧化钠反应制取氢氧化铜,反应式为Cu2++2OH—=Cu(OH)2↓;(2)葡萄糖与新制氢氧化铜混合直接加热需要试管、酒精灯,从液体中分离出Cu2O沉淀需要烧杯、漏斗、玻璃棒;(3)探究该反应发生的最低温度,可以选择水浴加热,需要温度计测量水浴的温度;(4)锌与非氧化性酸、难挥发性酸反应可以制取氢气,则a装置应加入稀H2SO4;(5)装置d增加的质量源自c中反应所生成水,由此可以计算出样品中氧元素的质量,c反应后所得固体的质量等于铜的质量,根据上述两种元素的质量可以测出氧化亚铜的纯度,故BC正确;(6)打开K2,关闭K1,通氢气一会儿后再加热c装置;(7)将不溶物再次干燥后称量,直至最后两次质量基本相同(或其他合理答案),说明不溶物是否巳完全干燥;(8)由m/M可知n(Cu)=n/64mol,由Cu2O+2H+=Cu2++Cu+H2O可知n(Cu2O)=n/64mol,由n?M可知m(Cu2O)=144n/64g=9n/4g,则样品中Cu2O的纯度为9n/4m×100%。
本题难度:一般
5、选择题 CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是(?)
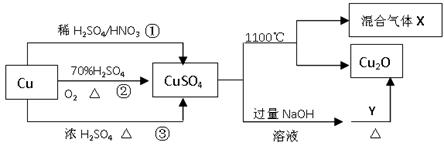
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol
D.Y可以是葡萄糖
参考答案:C
本题解析:
试题分析:1molCuSO4在1100℃所得混合气体X为SO2,O2,其中存在可逆反应SO2+O2 SO3,O2不一定为0.75mol4的制备
SO3,O2不一定为0.75mol4的制备
点评:本题考查CuSO4的制备,做题时,应注意框图之间各物质的联系,利用可逆反应的特征来解题。考查学生的综合能力,难度一般。
本题难度:简单