微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 根据硫化氢气体的实验室制法和性质完成下列填空.
(1)若用启普发生器制取硫化氢气体,则制取气体的原料可选用______.
a.稀硫酸与硫化亚铁?????????b.稀硝酸与硫化亚铁
c.稀硫酸与硫化钠???????????d.稀盐酸与硫化亚铁
(2)现要组装一套可以控制硫化氢气体产生速率的装置,请在图1中选择合适的仪器:______(填编号).

(3)如图2,在一个充满氧气的集气瓶中加入少量品红稀溶液,点燃硫化氢气体.在火焰自动熄灭后,停止通入气体,瓶内可观察到的现象是______.
(4)在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:______反应过程中,溶液的pH______(填“变大”、“变小”或“不变”).
(5)点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置.图3的装置能起到此作用的是______.
(6)已知硫化氢气体在空气中的体积分数为4.3%-45.5%时会发生爆炸.当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是______.
参考答案:(1)若用启普发生器制取气体,所选试剂应为块状固体和液体,且
本题解析:
本题难度:一般
2、实验题 为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验,将乙醇与浓硫酸的混合液加热至170℃,将生成 气体通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。
(1)写出乙烯与溴反应的化学方程式____。
(2)乙同学在甲同学的实验中发现,生成的气体有刺激性气味,推测产生的气体除乙烯外,还有副产物
SO2和 CO2,SO2也能使溴水褪色:SO2+Br2+2H2O==H2SO4+2HBr。于是对甲同学的结论提出质疑。为确 认乙烯能使溴水褪色,甲同学在实验时先将混合气体通过足量的____ (填序号)以除去其中的SO2, 再通人溴水看能否使溴水褪色。
A.氯水
B.NaOH溶液
C.酸性KMnO4溶液
(3)乙同学又提出质疑,认为乙烯使溴水褪色也可能发生了取代反应:CH2=CH2+Br2→CH2CHBr+ HBr。 甲同学认为很有道理,于是又做了一个简单的实验来确认是否发生取代反应,该实验所用的物质是_________ ,可能的现象和结论是____________ 。
参考答案:(1)CH2=CH2 +Br2→BrCH2-CH2Br
本题解析:
本题难度:一般
3、填空题 (15分)
阅读分析材料,据此完成下列要求。
工业纯碱中常含有少量的NaCl和NaOH。某校课外活动小组的同学为测定纯碱样品中
Na2CO3的质量分数,选择下列适当装置进行连接,并对设计方案不断完善,成功完成了
测定实验。
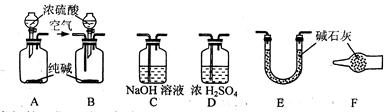
?
⑴活动小组的五位同学对实验装置的设计进行了讨论发言,内容如下:
甲:将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,分别测量反应前和反应后E的总质量,就可求出Na2CO3的质量分数。
乙:还应在A和E之间连接装置??????(填序号),其目的是??????????????????????。
丙:应该用B装置取代A装置。从B装置的导管口处缓慢鼓入空气,其目的是?????。
丁:若直接向B装置中鼓入空气会导致实验测定结果????????(填“偏高”、“偏低”或
“无影响”),因此,应将鼓入的空气先通过装置?????????????????(填序号)。
戊:E装置后还应连接装置F,其作用是????????????????????。
⑵学生课外活动小组测定的数据如下,计算该工业纯碱中Na2CO3的质量分数为??????。
工业纯碱样品质量
| 反应前E的总质量
| 反应后E的总质量
| 6.4g
| 51.9g
| 54.1g
⑶简述实验室测定上述样品中Na2CO3的质量分数的另一种方法(含实验仪器、实验步骤、实验现象)??????????????????????????????。
参考答案:(1)D(1分)??除去水(2分)??使二氧化碳充分排除以利
本题解析:涉及到仪器的组装,实验方案的评价,误差分析,及简单的计算和实验方案的设计,本题与2005年全国卷I实验类似,又有创新,值得分析一下,体会命题意图
本题难度:简单
4、实验题 (10分)某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL  NaOH溶液吸收过量的CO2气体,至CO2 NaOH溶液吸收过量的CO2气体,至CO2 气体不再溶解; 气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________.
此方案第一步的实验装置如下图所示:
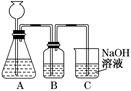
(2)加入反应物前,如何检验整个装置的气密性:________________________??????????________________________________________________
(3)若用大理石与盐酸制CO2,则装置B中盛放 的试剂是_____? 的试剂是_____? _,作用是_____________________________________________ _,作用是_____________________________________________
(4)在实验室通常制法中,装置A还可作为下列______????(填序号)气体的发生装置.
①HCl ②H2 ③O2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_______???????mol/L.
参考答案:(10分)(1)HCO+OH-===CO+H2O
(2
本题解析:略
本题难度:简单
5、填空题 某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去).请回答:
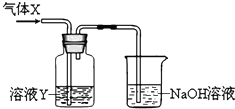
(1)若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是______反应的离子方程式为
______;NaOH溶液中发生反应的离子方程式是______
(2)若溶液Y为品红溶液,气体X通过后,溶液褪色,取少量褪色后的溶液加热后恢复为红色,则气体X可能是______(填化学式).
参考答案:(1)氯气有强氧化性,能把亚铁离子氧化生成铁离子,离子方程式
本题解析:
本题难度:一般
|
|