微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 已知A为常见金属,露置空气中较稳定,X、Y为常见非金属单质,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广。有关物质之间的转化关系如下图(注意:其中有些反应的条件及部分生成物被略去)
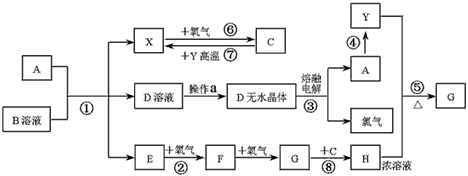
请填写下列空白:
(1)物质X的电子式____________;反应⑧中氧化剂与还原剂的物质的量之比为______;
(2)从D溶液制备D的无水晶体的“操作a”为______;
(3)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为:__________________;
(4)反应②的化学方程式为__________________;
(5)反应⑤中化学方程式为__________________。
参考答案:(1)H︰H;1︰2
(2)将D溶液在干燥的HCl气流
本题解析:
本题难度:一般
2、填空题 (13分) A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题:
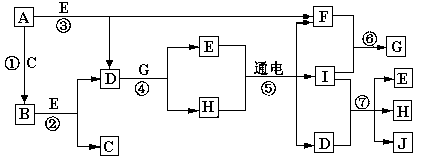
(1)B中的化学键有????????????????????,? E的电子式??????????????。
(2)写出反应⑦的离子方程式??? __________________________。
(3)上述七个反应中属于氧化还原反应的是_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)极附近溶液由无色变为红色,其原因是???????????????????????。
参考答案:(1)离子键、非极性键?(2分)? 本题解析:本题是无机框图题,根据是找准突破点。B为淡黄色粉末,则B是过氧化钠,所以A是钠,C是氧气。E在常温下为液体,且E可由C、F合成,所以E是水,F水氢气,D是氢氧化钠。J可用作杀菌消毒剂,根据反应⑤的条件可判断,I应该是氯气,因此H是氯化钠,G是氯化氢,J是次氯酸钠。
本题解析:本题是无机框图题,根据是找准突破点。B为淡黄色粉末,则B是过氧化钠,所以A是钠,C是氧气。E在常温下为液体,且E可由C、F合成,所以E是水,F水氢气,D是氢氧化钠。J可用作杀菌消毒剂,根据反应⑤的条件可判断,I应该是氯气,因此H是氯化钠,G是氯化氢,J是次氯酸钠。
本题难度:一般
3、推断题 已知X溶液有如图所示转化关系:

(1)根据上述转化关系,写出下列物质的化学式:X________、Y________、Z?_______、试剂甲_______,试剂乙_______?。
(2)写出上述各步反应①~④的离子方程式:
①______________;②______________;③_____________;④_______________?。
参考答案:(1)X:MgSO4;Y:Mg(OH)2;Z:MgCl2;试
本题解析:
本题难度:一般
4、填空题 (11分) 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如右图所示。
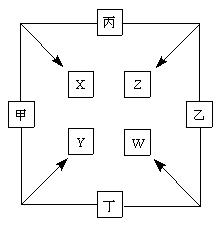
已知:
①????????甲、乙、丙均为前三周期元素的单质,常温下均为气体,丁是日常生活中的一种常见金属。
②????????常温下,X是无色液体,Y是黑色固体。
③????????丙在乙中燃烧发出苍白色的 火焰,W的水溶液呈黄色。
火焰,W的水溶液呈黄色。
请回答:
(1)写化学式:甲_____________, Z_____________。
(2)丁与X在高温下也能得到Y,请写出该反应的化学方程式
___________________________________________________。
(3)将少量W的溶液滴入几滴KSCN溶液,迅速变为红色,请写出该反应的化学方程式____________________________________________________。
(4)甲与丙两单质的元素可形成原子个数比1∶1的化合物H,将H滴入品红后,溶液的颜色逐渐褪去,加热后溶液为???????????(填颜色)。
(5)将Y恰好溶于Z的水溶液后,检验其中低价金属离子的方法是滴入酸性KMnO4,紫色褪去,说明有该离子,仔细分析后发现该结论存在缺陷,此“缺陷”是???????????????。
参考答案:(1) O2,HCl??????????? (2) 3Fe
本题解析:(1)无机推断题,要找准“题眼”,本题中③可作为切入点,丙在乙中燃烧发出苍白色的 火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
火焰,我们很容易推断,丙为H2,乙为Cl2,Z为HCl;W的水溶液呈黄色,则含有Fe3+,W为FeCl3,推丁为金属Fe;常温下,X是无色液体,X为H2O,则甲为O2,Y为Fe3O4
(2)丁与X在高温下也能得到Y的化学方程式
本题难度:简单
5、填空题 (8分)A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。

(1)写出A的电子式_____________。
(2)将X通入水玻璃溶液中,写出反应的离子方程式___________。
(3)自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________ g。
(4)写出区分B、C溶液的一种实验方案????????????????????????????????????????
参考答案:(1) 本题解析:根据物质的性质可知,A是氢氧化钠,B是碳酸钠,C是碳酸氢钠,X是CO2。
本题解析:根据物质的性质可知,A是氢氧化钠,B是碳酸钠,C是碳酸氢钠,X是CO2。
(1)氢氧化钠中还原离子键和极性键,电子式为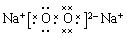 。
。
(2)碳酸的酸性强于硅酸的,所以方程式为2H2O+2CO2+SiO32--=H2SiO3↓+2HCO3-;或H2O+CO2+SiO32--=H2SiO3↓+CO32-。
(
本题难度:一般