微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 纳米材料二氧化钛(TiO2)可做优良的催化剂。
(1)工业上二氧化钛的制备方法是
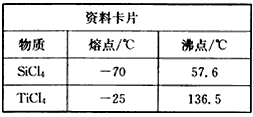
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.TiO2·xH2O高温分解得到TiO2。
①根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_________,分离二者所采取的操作名称是
__________。
②Ⅲ中反应的化学方程式是___________________。
③如Ⅳ在实验室完成,应将TiO2·xH2O放在______(填仪器编号)中加热。

(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a.O2→2O b.O+H2O→2OH c.OH+OH→H2O2
①b中破坏的是____(填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的____ (填“氧化性”或“还原性”)。
(3)某研究小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
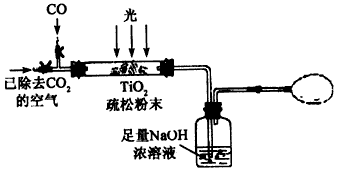
①如缓慢通入22.4 L(已折算成标准状况)CO气体,结果NaOH溶液增重11 g, 则CO的转化率为____。
②当CO气体全部通入后,还要通一会儿空气,其目的是___________。
参考答案:(1)①液态;蒸馏;②TiCl4+(x+2)H2O![]()
本题解析:
本题难度:困难
2、实验题 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时必需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)洗气瓶C中导管末端连接一个多孔球泡D,其目的是______________________________。
(2)洗气瓶C中的溶液还可以用其他试剂代替,如酸性高锰酸钾溶液,你认为选择酸性高锰酸钾溶液的理由有________________________________________________________。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。若某实验小组同学测得的SO2含量总是偏低,可能的原因是__________________________________________________。(假设实验装置、测量仪器、药品和实验操作程序均合理)
【乙方案】:实验步骤如下面流程图所示:

(4)写出步骤②中反应的化学方程式____________________________________________。
(5)步骤③中判断沉淀已经洗涤干净的方法是_______________________________________。
(6)实验中若通过的尾气体积为33.6L (已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该尾气中二氧化硫的含量是否达到排放标准(写出计算过程)。
参考答案:(10分)(1)增大气体与溶液的接触面积,有利于SO2与碘水
本题解析:
试题分析:(1)多孔球泡D能增大气体与溶液的接触面积,有利于SO2与碘水充分反应。
(2)因为酸性高锰酸钾溶液具有强氧化性,能够充分吸收SO2并与之反应,且酸性高锰酸钾溶液显紫红色,反应终了时现象易于观察。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则导致通过的气体偏多,因此测得的SO2含量偏低。测得的SO2含量总是偏低,可能的原因是通入尾气速率过快,SO2吸收不充分引起的。
(4)双氧水具有氧化性,能把SO2氧化生成硫酸,所以反应②的化学方程式是H2SO4+Ba(OH)2=BaSO4↓+2H2O。
(5)步骤③中判断沉淀已经洗涤干净的方法可以是沉淀法,也可以通过测量溶液的pH值,即取最后一次的洗涤液少许,用PH试纸测量PH值或加入Na2SO4溶液,看是否有浑浊出现(或其他合理答案)。
(6)最终所得固体是硫酸钡,其质量为0.233g,物质的量是0.233g÷233g/mol=0.001mol。又因为尾气的物质的量是33.6L÷22.4L/mol=1.5mol
所以该尾气中二氧化硫的含量是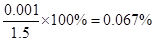
即SO2的体积分数大于0.05%,未达标2尾气吸收的综合性实验判断
点评:该题是中等难度的试题,也是高考中的常见考点,试题综合性强,侧重能力的培养和实验设计能力的训练,难度较大,学生不易得分。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
3、选择题 鉴别KCl、KI溶液的方法正确的是( )
A.分别加热溶液,有紫红色蒸汽产生的是KI溶液
B.分别加入淀粉,便蓝色的是KI溶液
C.分别加入四氯化碳振荡,静置后下层呈紫红色的是KI溶液
D.分别加入氯水、四氯化碳振荡,静置后下层呈紫红色的是KI溶液
参考答案:A.分别加热溶液,不发生反应,现象相同,不能鉴别,故A错误;
本题解析:
本题难度:简单
4、选择题 某酸性溶液中可能含有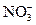 、I-、Cl-、Fe3+中的一种或几种离子,向其中加入溴水,溴水褪色,下列推测不正确的是
、I-、Cl-、Fe3+中的一种或几种离子,向其中加入溴水,溴水褪色,下列推测不正确的是
A.一定含I-
B.不含Fe3+
C.一定含Cl-
D.不含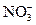
参考答案:C
本题解析:溴水褪色,一定含I-,Fe3+、NO-3(H+)不能与I-共存,一定无Fe3+、NO-3,Cl-不能确定。
本题难度:简单
5、填空题 (20分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:

已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有????????????????????_______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是___________?????????????????______。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
参考答案:(1)改变高岭土中氧化铝的结构,使其能溶于酸。
(2)
本题解析:“煅烧”的目的是改变高岭土中氧化铝的结构,使其能溶于酸。“浸出”过程中发生反应与酸反应。该酸要溶液挥发,不会形成杂质。为提高铝的浸出率,可采取的措施有加热或提高反应温度,将煅烧后的块状固体粉碎,适当增大盐酸浓度,充分搅拌,延长反应时间。控制温度的实验方法是水浴加热????。
本题难度:一般