2.0
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量(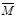 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 。
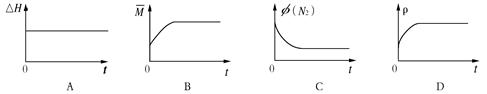
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
参考答案:(14分)
(1)(3△H1+2△H2)/5(2分)<
本题解析:
试题分析:(1)根据盖斯定律,将NO消去,可得4NH3(g)+3O2(g)=2N2(g)+6H2O(l)
△H=(3△H1+2△H2)/5;
(2)①T2到T1变化时,氨气的物质的量增大,说明改变温度,平衡正向移动,而正向是放热反应,所以温度变化是降低温度,则T1<T2;
②在T2 K下,经过10min达到化学平衡状态,氨气的物质的量是2mol,根据反应的化学方程式,则消耗氢气的物质的量是3mol,则0~10min内H2的平均速率v(H2)=3mol/3L/10min=0.1mol·L-1·min-1;消耗氮气的物质的量是1mol,所以氮气的转化率是1mol/4mol×100%=25%;
③A、反应的化学方程式固定,则反应热不变,所以不能判断为平衡状态,错误;B、该反应是气体的物质的量减小的可逆反应,所以气体的平均摩尔质量增大,达到平衡时,气体的平均摩尔质量不变,正确;C、随反应的进行,氮气的体积分数不断减小,达到平衡时,保持不变,正确;D、容器的体积不变,则气体的密度一直不变,所以不能判断为平衡状态,错误,答案选BC;
(3)①根据装置图中氢离子的移动方向判断M区为负极区,则N2H4在负极发生氧化反应,失去电子生成氮气和氢离子,电极反应式是N2H4-4e?==N2↑+4H+;
②用该电池电解氯化钠溶液,化学方程式是2NaCl+2H2O 2NaOH+H2↑+Cl2↑, 500mL的溶液的pH=13,则氢氧根离子的浓度是0.1mol/L,氢氧根离子的物质的量是0.05mol,根据得失电子守恒,所以电池中转移电子的物质的量是0.05mol,该燃料电池的能量利用率为80%,所以需要N2H4的质量为0.05mol/4×32g/mol/80%=0.5g。 2NaOH+H2↑+Cl2↑, 500mL的溶液的pH=13,则氢氧根离子的浓度是0.1mol/L,氢氧根离子的物质的量是0.05mol,根据得失电子守恒,所以电池中转移电子的物质的量是0.05mol,该燃料电池的能量利用率为80%,所以需要N2H4的质量为0.05mol/4×32g/mol/80%=0.5g。
考点:考查盖斯定律的应用,反应速率的计算,平衡状态的判断,电化学反应原理的应用
本题难度:困难
2、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
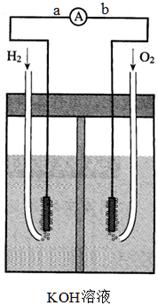
(1)氢氧燃料电池的能量转化主要形式是由???????转化为????????,在导线中电流方向为???????→??????(用a、b 表示)。
(2)正极反应式为?????????????????????,负极发生?????????反应(填“氧化”或“还原”)。
(3)氢氧燃料电池的能量转化率??????????????100%(填<、>、=)。
(4)电极表面镀铂粉的原因为????????????????????????????????。
参考答案:(12分)(1)化学能转化为电能???? b→a
(2
本题解析:
试题分析:(1)该题目中,氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,在原电池中,电流从正极流向负极,而通入燃料氢气的电极是负极,通氧气的电极是正极,所以电流从b到a,故答案为:化学能转化为电能;从b到a;
(2)燃料电池中,通入燃料氧气的电极是正极,反应式为O2+2H2O+4e-=4OH-,通入燃料氢气的电极是负极,通氧气的电极是正极,故答案为:负;
(3)在反应过程中会有部分能力损失,故氢氧燃料电池的能量转化率<100%;
(4)根据题目信息:“电池电极
本题难度:一般
3、实验题 (15分)高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。电解法制备高铁酸钾操作简便,成功率高,易于实验室制备。其原理如下图所示。
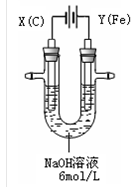
I. 实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(1)电解过程中,X极是 极,电极反应是 。
(2)电解过程中,Y极放电的有 。
(3)生成高铁酸根(FeO42-)的电极反应是 。
II. 若用不同种电池作为上述实验的电源,请分析电池反应。
(1)铅蓄电池总的化学方程式为:
2H2O+2PbSO4 Pb+PbO2+2H2SO4,则它在充电时的阳极反应为 Pb+PbO2+2H2SO4,则它在充电时的阳极反应为
。
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH--2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为 。
(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料。已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N2H4完全燃烧的热化学方程式是 ;
肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是 。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O。
写出该电池正极的电极反应: 。
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是 。
参考答案:Ⅰ.(1)阴;2H++2e-= H2↑。(2)Fe和OH-&
本题解析:I.(1)X和电源的负极相连,所以是阴极,溶液中的氢离子放电,方程式为2H++2e-= H2↑。
(2)Y和电源的正极相连,作阳极。由于Y是铁,所以铁失去电子,发生氧化反应。根据实验现象可判断,在阳极上溶液中的OH-也放电生成氧气。
(3)阳极铁失去电子,氧化产物是高铁酸根,反应式为Fe+8OH--6e-= FeO42-+4H2O。
II.(1)充电相当于电解,在电解池中阳极失去电子,发生氧化反应。根据反应式可判断,充电时硫酸铅失去电子,所以电极反应式为PbSO4+2H2O-2e-= PbO2+SO42-+4H+。
(2)在原电池中正负极的电极反应式相叠加即得到总反应式,所以反应式为Cd+2NiOOH+2H2O = Cd(OH)2+2Ni(OH)2。
(3)32.0g N2H4是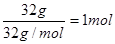 ,所以热化学方程式为N2H4(1)+O2(g)= N2(g)+2H2O(l)△H=-624kJ/mol。在燃料电池中负极是失去电子的,所以肼在负极通入,发生氧化反应,氧化产物是氮气,反应式为N2H4+4OH--4e-= 4H2O+N2↑。 ,所以热化学方程式为N2H4(1)+O2(g)= N2(g)+2H2O(l)△H=-624kJ/mol。在燃料电池中负极是失去电子的,所以肼在负极通入,发生氧化反应,氧化产物是氮气,反应式为N2H4+4OH--4e-= 4H2O+N2↑。
(4)负极通入丙烷,丙烷的氧化产物是CO2和水,由于电解质水熔融的碳酸盐,所以电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,根据总反应式可知,正极反应式为5O2+10CO2+20e-= 10CO32-。
(5)1molPb、Cd、肼、丙烷失去的电子分别为2mol、2mol、4mol、20mol,所以根据得失电子守恒可知,Pb、Cd、肼、丙烷的物质的量之比是10:10:5:1。
本题难度:困难
4、选择题 汽车的启动电源常用铅蓄电池。下列叙述正确的是 [???? ]
A. 放电时,电子从PbO2一极流入铅板
B. 放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4
C. 充电时,PbO2得到电子,被氧化
D. 放电时,溶液的酸性增强
参考答案:B
本题解析:
本题难度:一般
5、选择题 有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池.该电池中反应的化学方程式为:CH4+2O2+2KOH═K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)( )
A.通过甲烷的电极为电池的负极,通过氧气的电极为正极
B.在标准状况下,每消耗5.6?L?O2,可向外提供2.4×104?C的电量
C.通过甲烷电极的电极反应为:CH4+10OH--8e-═CO32-+7H2O
D.放电一段时间后,溶液的pH升高
参考答案:A.根据原电池总反应式可知甲烷被氧化,应为原电池的负极反应,
本题解析:
本题难度:简单
|