微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH?="=" K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04? ="=" K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203="=" Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用??????滴定管移取步骤 ③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是:??????????????;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是?????????????;
(3)步骤④的A溶液最合适的是????????????;滴定终点的判断方法是???????????????????????????????????????????????????????????????????????;
(4)步骤④应该选用???????????(填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
序号
| 滴定前/mL
| 滴定后/mL
|
①
| 1.35
| 19.40
|
②
| 1.05
| 19.00
|
③
| 1.58
| 20. 91 91
根据数据计算该样品中总二氧化硫的浓度为??????mol/L,故该干白葡萄酒是??????(填“合格”“不合格”)产品。
参考答案:(10分)
(1)I2+SO2+2H2O==4H++2
本题解析:略
本题难度:一般
2、选择题 下列实验的异常情况的原因分析不正确的是
选项
| 实验内容
| 实验的异常情况
| 原因分析
| A
| 制备Fe(OH)2
| 观察不到白色沉淀
| 可能原料中的Fe2+被氧化或未隔绝空气
| B
| 蒸发结晶
| 蒸发皿破裂
| ?酒精灯灯芯碰到热的蒸发皿底部或蒸发到剩少量液体时继续加热
| C
| 分离水和CCl4
| 打开分液漏斗活塞后,下层液体难以流出
| 没有装漏斗上塞子拔掉或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐
| D
| 点燃法除去CO2中的CO杂质
| 无法点燃
| CO的着火点较高
参考答案:D
本题解析:D.点燃法除去CO2中的CO杂质,无法点燃的原因在于氧气很少,二氧化碳很多,二氧化碳不支持燃烧;正确操作为,通过灼热的氧化铜粉末。
本题难度:简单
3、简答题 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸.
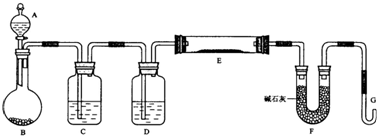
请回答下列问题.
(1)仪器中装入的试剂:B______、C______、D______;
(2)连接好装置后应首先______,其方法是______
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是______.在这两步之间还应进行的操作是______;
(4)反应过程中G管逸出的气体是______,其处理方法是______
(5)从实验中测得了下列数据
①空E管的质量a;?②E管和WO3的总质量b;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=______;计算式2:Ar(W)=______.
参考答案:(1)实验室用金属锌和稀硫酸反应来获得氢气,氢气可以用浓硫酸
本题解析:
本题难度:一般
4、选择题 下列反应的离子方程式书写正确的是??????????????????????????????????????
A.钠和冷水反应 Na+2H2O=Na++2OH?+H2↑
B.金属铝溶于氢氧化钠溶液 Al+2OH?=AlO2?+H2?
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2?
参考答案:CD
本题解析:
试题分析:A不正确,没有配平,应该是2Na+2H2O=2Na++2OH-+H2↑;B不正确,应该是2Al+2H2O+2OH-==2AlO2-+3H2↑,答案选CD。
点评:本题是高考中的常见题型,试题基础性强,难易适中,有利于培养学生灵活运用知识解决实际问题的能力。
本题难度:简单
5、实验题 (12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案:???????????????????????????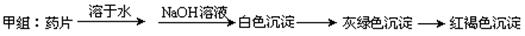 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果, 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:

(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁??
②?????????????????????????????????????????????????????????????????。
(3)请你对其中一种可能 进行实验验证:________________________________ 进行实验验证:________________________________
实验方案(用文字述):________________________________________________ ,
根据预期现象判断结论:________________________________________________________ 。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
序号
| V(KMnO4)初
| V(KMnO4)终
| V(KMnO4)
| 1
| 2.24mL
| 14.25mL
| 12.01mL
| 2
| 0.30mL
| 12.72mL
| 12.42mL
| 3
| 0.50mL
| 12.53
| 12.03mL
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。
参考答案:(12分)(1)该药片在水中溶解度不大,少量溶解后的溶液中几
本题解析:略
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772