微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)0.5 mol H2 O的质量为_______________,其中含有_______________个水分子,共有_______________个原子。
(2)质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_______________;在相同温度和相同压强条件下,体积最大的是_______________,体积最小的是_______________。
参考答案:(1)9g,3.01×1023,?? 9.03×1023
本题解析:
试题分析:(1)0.5 mol H2O的质量为:0.5mol×18g/mol=9g;含水分子:0.5mol×6.02×1023=3.01×1023,共有原子数目:3.01×1023×3=9.03×1023。
(2)质量相等,摩尔质量越大的物质分子的物质的量越少,体积最小,摩尔质量越小,物质的量越大,体积越大,HCl、NH3、CO2、O2四种气体,CO2的摩尔质量最大,所以CO2含有分子数目最少,体积最小,而NH3的摩尔质量最小,所以NH3的体积最大。
本题难度:一般
2、选择题 若20 g密度为ρ g·cm-3的Ca(NO3)2溶液里含1 g Ca2+,则NO-3的浓度是(??? )
A. mol·L-1
mol·L-1
B. mol·L-1
mol·L-1
C.2.5ρ mol·L-1
D.1.25ρ mol·L-1
参考答案:C
本题解析:根据溶液中电荷守恒,可得下式:
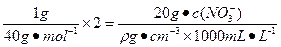
c(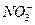 )="2.5ρ" mol·L-1
)="2.5ρ" mol·L-1
本题难度:简单
3、选择题 实验室需配制一种c (H+)=2mol/L的强酸溶液500mL,下列配制方法可行的是(? )
A.取100mL5mol/LH2SO4,加入400mL水
B.取200mL5mol/LHCl,加水稀释至500mL
C.取200 mL5mol/LH2SO4,加水稀释至500mL
D.取100 mL5mol/LHNO3,加水稀释至500mL
参考答案:B
本题解析:
试题分析:A溶液的体积不等于原溶液的体积与加入的水的体积之和,错误。B利用稀释公式C1V1=C2V2可得C2=2mol/L,C(H+)="C(HCl)" =2mol/L,正确。C利用稀释公式可得稀释后C(H2SO4)=" 2mol/L," C(H+)=2C(H2SO4)= 4mol/L,错误。D中,C(H+)=1mol/L,错误。
本题难度:一般
4、填空题 ①、同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
②、某温度下22% KCl溶液150mL,加100g水稀释后浓度为14%,则原溶液的物质的量浓度为 。
③、10g NaOH溶解在 g水中,才能使每10个水分子中溶有1个Na+,此时溶液(密度为1g/cm3)的物质的量浓度为 。
参考答案:30、①、16 6.02×1022或
本题解析:
试题分析:(1)同温同压下,同体积的气体,质量之比等于摩尔质量之比,0.2g:1.6g=2g/mol:M(A),解得M(A)=16g/mol,A的相对分子质量为16,1.6gA的物质的量为1.6/16=0.1mol,A的分子数目为0.1mol×NAmol-1=0.1NA,答案为:16,0.1NA。(2)设原溶液质量为Xg 0.22×X=(X+100)×0.14 解得X="175g" 原溶液的物质的量浓度=[(175×0.22)÷74.5]/0.15=3.5mol/L;
(3)10g NaOH的物质的量为10/40=0.25moL,每10个水分子中溶有1个Na+,水的物质的量为2.5mol,质量为45g.,此时溶液的浓度为c=0.25/[(55÷1)X10-3]=0.25/0.055=4.45mol/L。
考点:考查物质的量的计算,溶液的稀释,物质的量浓度的计算等知识。
本题难度:一般
5、填空题 现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为?????????????????,所得溶液中的溶质物质的量浓度为?????????????mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为?????mL,所得溶液溶质物质的量浓度为 ?????mol·L-1。
参考答案:①2H++ SO42—+ Ba2+ + 2OH—=BaSO4
本题解析:
试题分析:n(H+)="0.1×0.1×2=0.02(" mol),n(SO42-)="0.1×0.1" +0.1×0.1 ="0.02(" mol);n(Ba2+)="0.2×0.05=0.01(" mol),n (OH-)="0.2×0.05×2=0.02(" mol),所以反应实质是H2SO4和Ba(OH)2溶液反应。离子方程式是:2H++ SO42—+ Ba2+ + 2OH—=Ba SO4 ↓+2 H2O。反应后的溶液为Na2SO4溶液其浓度为:C(Na2SO4)=n∕V=0.1×0.1m
本题难度:一般