微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1) 25℃时,部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
|
电离平衡常数
| Ki=1.7×10-4
| Ki=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
①HCOONa溶液呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)。
②在测定c(H+)相等的盐酸和HCOOH溶液的pH时,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是________(填“盐酸”或“HCOOH”),原因是 。
③将少量CO2通入NaCN溶液中,它们是否能反应(若能,写出反应的离子方程式;若不能,直接填“否”) 。
(2)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

①M、N点对应的温度分别是T1、T2,则T1 T2(填“>”、“=”或“<”)。
②T2时,水的离子积常数Kw= ,pH=9的NaOH溶液中,由水电离产生的c(H+)= mol/L。
2、选择题 下列事实能够说明亚硝酸(HNO2)为弱电解质的是( )
A.0.1mol/L的亚硝酸水溶液的PH=2.1
B.亚硝酸不与硫酸钠溶液反应
C.25℃时,HNO2的水溶液的PH<7
D.用亚硝酸做导电实验时,灯泡很暗
3、简答题 硫酸氢钠(NaHSO4)溶于水能电离生成两种阳离子和硫酸根离子。请据此回答下列问题:
(1)电离生成的阳离子是哪两种?写出硫酸氢钠的电离方程式。__________________________
(2)硫酸氢钠是不是酸?为什么?______________________________________
(3)硫酸氢钠是不是盐?为什么?______________________________________
4、填空题 甲、乙两同学拟用实验确定某酸HA是弱电解质。他们的方案分别是:
甲:①称取一定质量的HA配制0.1 mol/L的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电质的理由是测得溶液的pH 1(选填“>”、“<”或“=”)。简要说明pH试纸的使用方法: 。
(3)乙方案中,说明HA是弱电解质的现象是
。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),并作简明扼要表述: 。
5、选择题 根据下表数据(均在同温、同压下测定)可得出弱电解质强弱顺序正确的是
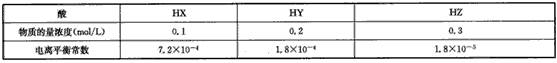 [???? ] [???? ]
A.HX>HY>HZ
B.HZ>HY>HX
C.HY>HZ>HX
D.HZ>HX>HY
|