微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:
①1mol H2分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是
[???? ]
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成氯化氢气体的反应是吸热反应
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列变化为放热的化学反应的是
A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
B.2HI(g)===H2(g)+I2(g)
ΔH=+14.9 kJ·mol-1
C.形成化学键时共放出862 kJ能量的化学反应
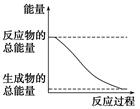
D.能量变化如右图所示的化学反应
参考答案:D
本题解析:
试题分析:A、状态变化,不是化学反应,故A错误;B、ΔH>0,为吸热反应,故B错误;C、只知道形成化学键时放出的热量,不知道断裂化学键时吸收的能量,不能判断是吸热反应还是放热反应,故C错误;D、反应物的总能量大于生成物的总能量,故为放热反应,故D正确;故选D。
考点:放热反应的判断。
本题难度:一般
3、填空题 (8分)某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
实验用品
| 溶液温度
| 中和热
|
|
T1
| t2
| ΔH
|
①
| 50 mL0.55 mol·L-1
NaOH溶液
| 50 mL0.5 mol·L-1
HCl溶液
| 20 ℃
| 23.3 ℃
|
|
②
| 50 mL0.55 mol·L-1
NaOH溶液
| 50 mL0.5 mol·L-1
HCl溶液
| 20 ℃
| 23.5 ℃
(已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。)
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果 (填“有”或 “无”)影响;若用醋酸代替HCl做实验,对测定结果 (填“有”或“无”)影响。
参考答案:(8分) (1)量筒(1分) 温度计(1分)
(2)否
本题解析:
试题分析:本题考查中和热的测定。在实验中需要测量溶液的体积,所以需要量筒,同时还需要测量温度,所以需要温度计;在实验过程中要尽可能的减少热量损耗,而金属铜是热的良导体,所以不能用环形铜丝搅拌棒代替环形玻璃搅拌棒;根据实验数据知两次实验中的温度差的平均值为: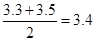 ℃,所以反应中放出的热量Q=4.18KJ·℃-1·Kg-1×0.1kg×3.4℃=1.4212KJ。因为反应中生成的水的物质的量为0.025mol,所以?H= ℃,所以反应中放出的热量Q=4.18KJ·℃-1·Kg-1×0.1kg×3.4℃=1.4212KJ。因为反应中生成的水的物质的量为0.025mol,所以?H= kJ·mol-1,因此反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ?H=56.8kJ·mol-1;KOH属于强碱,对属于结果无影响,但醋酸属于弱酸,溶于水会吸热,因此测定结果有影响 kJ·mol-1,因此反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ?H=56.8kJ·mol-1;KOH属于强碱,对属于结果无影响,但醋酸属于弱酸,溶于水会吸热,因此测定结果有影响
考点: 中和热的测定
本题难度:一般
4、填空题 Na3N是一种重要的化合物,是由______键形成的,其中两种粒子的半径关系是:Na+______N3-(填“>”、“=”或“<”).
参考答案:氮化钠是离子晶体,由钠离子和氮离子构成,所以钠离子和氮离子之
本题解析:
本题难度:一般
5、选择题 将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断不正确的是
A.与NaOH反应的氯气一定为0.15?mol
B.n(Na+):n(Cl-)?可能为7:3
C.若反应中转移的电子为nmol,则n一定大于0.15?mol
D.n(NaCl):n(NaClO):n(NaClO3)可能为7:2:1
参考答案:B
本题解析:分析:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3),再根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3),据此计算;
B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl-)最小为6:5,据此判断;
C、利用极限法解答,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,氧化产物只有NaClO3,转移电子数最多;
D、令n(NaCl)=7mol,n(NaClO)=2mol,n(NaClO3)=1mol,根据电子转移守恒验证判断.
解答:A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A正确;
B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误;
C、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,为0.3mol× ×1=0.15mol,氧化产物只有NaClO3,转移电子数最多,为0.3mol× ×1=0.15mol,氧化产物只有NaClO3,转移电子数最多,为0.3mol× ×1=0.25mol,故C正确; ×1=0.25mol,故C正确;
D、令n(NaCl)=7mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为7mol×1=7mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子相等,故D正确;
故选B.
点评:本题考查氧化还原反应计算、根据方程式的计算等,难度较大,注意极限法与守恒法的利用.
本题难度:简单
|