微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1
2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于[???? ]
A.-317.3kJ·mol-1
B.-379.3kJ·mol-1
C.-332.8kJ·mol-1
D.+317.3kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
2、简答题 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
(1)850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O(g),CO和H2O(g)浓度变化如右图所示,下列说法正确的是______(填序号).
A.达到平衡时,反应体系最终会放出49.44kJ热量
B.第4min时,混合气体的平均相对分子质量不再变化,可判断已达到平衡
C.第6min时,若升高温度,反应平衡常数会增大
D.第8min时,若充入CO,会导致v(正)>v(逆),平衡向正反应方向移动
(2)850℃时,若在容积为2L的密闭容器中同时充入1.0mol?CO、3.0mol?H2O、1.0mol?CO2和x?mol?H2.若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
(3)如将H2?与CO2以4:1的体积比混合,在适当的条件下可制得CH4.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=-890.3kJ/mol
H2(g)+
1
2
O2(g)═H2O(l)△H2=-285.8kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是______.
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极.负极反应式为______,正极反应式为______.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定.为此电池工作时必须有部分A物质参加循环,则A物质的化学式是______.实验过程中,若通入了标准状况下空气448L(假设空气中O2体积分数为20%),则熔融盐燃料电池消耗标准状况下CH4______L.
参考答案:(1)A.1.2mol水蒸气参加反应,通常条件下放出的热量为
本题解析:
本题难度:一般
3、填空题 把煤作为燃料可通过下列两种途径:
途径Ⅰ
C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃料水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g); ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
(3)已知:
① C(s)+O2(g)=CO2(g);??ΔH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g);??ΔH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);??ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=______________。
(4)已知下列各组热化学方程式
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
(3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式________________________。
(5)在标准状况下的11.2L甲烷完全燃烧生成CO2和液态水放出444.8KJ热量(298K),其热化学方程式为___________________已知断裂下列1mol化学键需要吸收的能量分别为:C=O:745KJ/mol,
O=O:496kJ/mol , C-H:414KJ/mol 则断裂1molH-O键需要提供的能量为_____________kJ
参考答案:(1)等于
(2)ΔH1=ΔH2+(ΔH3+ΔH4)/
本题解析:
本题难度:一般
4、选择题 已知:
2CO(g)+O2(g)=2CO2(g) △H= -566 kJ/mol
N2(g)+O2(g) =2NO(g)△H=+180 kJ/mol
则2CO(g)+2NO(g)=N2(g)+ 2CO2(g)的△H是
[???? ]
A.-386 kJ/mol
B. +386 kJ/mol
C.?-746 kJ/mol
D. +746 kJ/mol
参考答案:C
本题解析:
本题难度:一般
5、填空题 ?“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___?C+?___?KMnO4+?____?H2SO4→____CO2↑+?____MnSO4?+?____K2SO4+?____H2O??
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)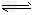 CO2(g)+H2(g),得到如下三组数据 CO2(g)+H2(g),得到如下三组数据
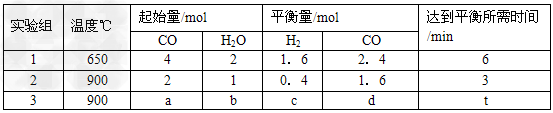
①实验1条件下平衡常数K=________(取小数二位,下同)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b?的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时
V正______V逆(填“<、>、=”)。
(3)已知在常温常压下:
①?2CH3OH(l)?+?3O2(g)?=?2CO2(g)?+?4H2O(g)???ΔH?=?-1275.6?kJ/mol
②?2CO(g)+?O2(g)?=?2CO2(g)???ΔH?=?-566.0?kJ/mol
③?H2O(g)?=?H2O(l)???ΔH?=?-44.0?kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________
(4)最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。该构想技术流程如下:
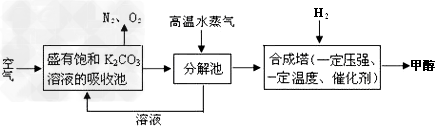
向分解池中通入高温水蒸气的作用是_______________________________?????
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。
CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L?,则生成沉淀所需CaCl2溶液的最小浓度为________________?。
参考答案:(1)5、4、6、5、4、2、6
(2)①2.67;②
本题解析:
本题难度:一般
|