微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用下列实验装置进行的实验,能达到相应的实验目的的是(??)
参考答案:A
本题解析:略
本题难度:简单
2、填空题 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是????????。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除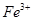 外还可能含有
外还可能含有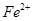 。若要确认其中的
。若要确认其中的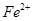 ,应选用??????选填序号)。
,应选用??????选填序号)。
a.KSCN溶液和氯水???? b.铁粉和KSCN溶液??
c.浓氨水????????????? d.酸性 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
 ?,然后加入足量
?,然后加入足量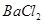 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中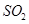 的体积分数为???????????。
的体积分数为???????????。
[探究二]
分析上述实验中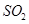 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有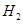 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
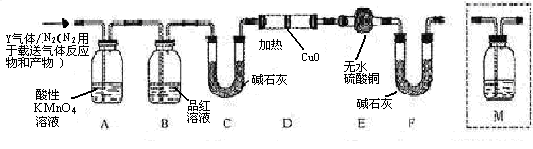
(3)装置B中试剂的作用是???????????。
(4)认为气体Y中还含有Q的理由是???????????(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于????????????(选填序号)。
a. A之前????? b.A-B间?????? c.B-C间?????? d.C-D间
(6)如果气体Y中含有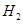 ,预计实验现象应是???????????。
,预计实验现象应是???????????。
参考答案:(14分)[探究一](1)钝化 (2)①d??②66.7%?
本题解析:
试题分析:(1)由于在常温下,铁在浓硫酸中发生钝化,所以钝化后的铁不能在和硫酸铜溶液反应。
(2)①由于亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,溶液褪色,所以检验亚铁离子的是试剂是酸性高锰酸钾溶液,答案选d。
②所得固体是硫酸钡,其质量是2.33g,物质的量是0.01mol,则根据反应的化学方程式可知,SO2的我知道了也是0.01mol,标准状况下的体积是224ml,所以气体Y中SO2的体积分数为 。
。
(3)由于铁钉中还含有碳元素,所以生成的气体中还可能含有CO2,检验CO2用石灰水,但SO2也能使石灰水变混浊,所以A装置首先是除去SO2,则B中品红溶液的主要是就是验证二氧化硫是否除尽。
(4)碳和浓硫酸反应的化学方程式是2H2SO4(浓)+C 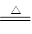 ?2H2O+2SO2↑+CO2↑。
?2H2O+2SO2↑+CO2↑。
(5)在检验氢气之前就要首先检验CO2,所以M装置应该放在B和C之间,答案选C。
(6)由于氢气具有还原性,能和氧化铜反应生成铜和水,所以实验现象就是D中黑色变红色,E中白色变成蓝色。
点评:钢铁是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的和解题方法的指导与训练,有利于培养学生规范、严谨的实验设计和评价能力,提升学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
3、选择题 某学习小组根据化学知识和表格的数据,设计了下表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子,其中不合理的是
物质
| 电离常数和溶解度(25℃)
|
C6H5OH]
| Ki?=1.28×10-10
|
S = 9.3g/100g水
|
H2CO3
| Ki1 =4.3×10-7
|
Ki2 =5.6 ×10-11 ×10-11
?
?
| 组别
| 操作
| 判断依据
| A
| 盐酸和碳酸
| 往碳酸钙固体中滴加盐酸
| 观察有无气体产生
| B
| 碳酸与苯酚
| 往苯酚钠饱和溶液中,通入足量CO2
| 观察溶液是否变浑浊
| C
| 碳酸与苯酚
| 配制同物质的量浓度的碳酸钠溶液和苯酚钠溶液
| 比较溶液的pH
| D
| HCO3-与苯酚
| 在苯酚悬浊液中,加入过量的 Na2CO3溶液
| 观察悬浊液是否变澄清
参考答案:CD
本题解析:略
本题难度:一般
4、简答题 电石浆是氯碱工业中的一种废弃物,其大致组成如表所示:
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质
质量分数(%)
65~66
3.5~5.0
1.5~3.5
0.2~0.8
0.2~1.1
1.0~1.8
23-26
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
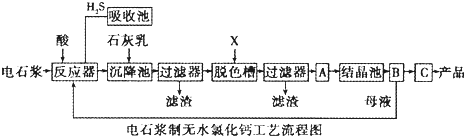
已知氯化钙晶体的化学式是:CaCl2?6H2O;H2S是一种酸性气体,且具有还原性.
(1)反应器中加入的酸应选用______.
(2)脱色槽中应加入的物质X是______;设备A的作用是______;设备B的名称为______;设备C的作用是______.
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是______.反应的化学方程式为______.
A.水B.浓硫酸C.石灰乳D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______.
(5)氯碱工业电极方程式______.
参考答案:(1)因要生产CaCl2,过程中不引入新的杂质离子,所以应选
本题解析:
本题难度:一般
5、实验题 (10分)某化学学习小组在实验室里利用下图装置测定中和反应中的热效应。实验时将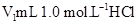 溶液和 溶液和 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持 未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,所得实验结果如右下图所示(实验中始终保持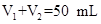 )。 )。
据此请回答下列问题:
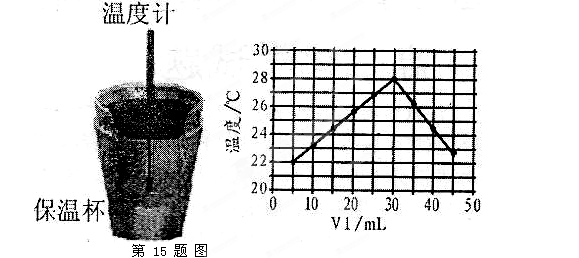 (1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。 (1)从实验装置上看,左图中尚缺少的一种玻璃用品是________________________。
(2)保温杯的作用是_______________________________________________________。
(3)某同学根据所得数据,提出了以下观点,其中正确的是______________________。
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.该实验表明有水生成的反应都是放热反应
(4)利用图中所给数据,可测得NaOH溶液的浓度约为______________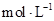
(5)除了使用保温杯外,为了保证实验成功,还要注意哪些问题(说出1点即
可) ____________________________
参考答案:(1)环形玻璃搅拌器(2)防止热量散失(3)B (4)1.5
本题解析:(1)反应时需要搅拌,所以还缺少环形环形搅拌棒。
(2)在实验中,应该尽可能减少热量的损失,所以保温杯的作用是减少热量的损失。
(3)根据图像可知,当V1=0时,溶液的温度不是22℃,A不正确。随着反应的进行,溶液的温度升高,所以反应放热,B正确。选项C和实验无关系,不正确,答案选B。
(4)当酸碱恰好反应时,放出的热量最多,所以根据图像可判断,氢氧化钠的浓度是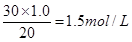 。 。
(5)在实验中,应该尽可能减少热量的损失,所以使用的盐酸和氢氧化钠溶液的浓度要小不要大;温度计的水银球部分要完全浸在溶液中
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772