微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某硝酸钾固体试样中含有少量的硫酸钾,设计一套实验从中得到纯净的硝酸钾晶体。 硝酸钾和硫酸钾的溶解度(S/g)
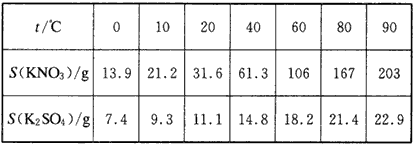
参考答案:(1)将试样混合物溶于水中,得到混合液;
(2)加热
本题解析:
本题难度:一般
2、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
选项
| 实验操作
| 实验目的或结论
|
A
| 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
| 说明该钾盐是K2CO3
|
B
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
C
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
| 说明常温下K sp(BaCO3)<K sp(BaSO3)
|
D
| C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液
| 检验制得的气体是否为乙烯
参考答案:B
本题解析:略
本题难度:一般
3、实验题 某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。
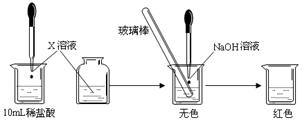
则X溶液是?? ▲???。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。
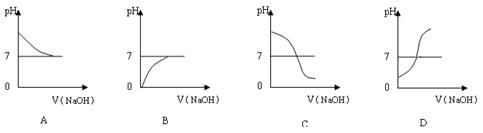
①写出测定溶液pH值的操作方法:?? ▲???;
②上图中哪个图像符合该同学的记录?? ▲???(填序号)。
(3)你认为甲、乙两位同学的实验中,?? ▲???(填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:?? ▲???。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
滴定次数
| 盐酸的体积/mL
| ?? NaOH溶液的体积/mL
| 滴定前刻度/mL
| 滴定后刻度/mL
| ??? 1
| 25.00
| ??? 2.00
| 20.20
| ??? 2
| 25.00
| ???1.02
| 21.03
| ??? 3
| 25.00
| ???0.20
| 20.20
(1) 根据以上数据计算出盐酸的物质的量浓度为?? ▲???mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。?? ▲???。
参考答案:(12分)
Ⅰ.(1)酚酞(2分)
(2)①用干
本题解析:略
本题难度:简单
4、填空题 (10分)(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
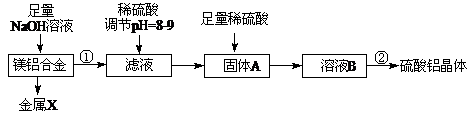
则镁铝合金中加NaOH溶液的化学反应方程式为???▲???,
金属X是??▲??,固体A的化学式???▲????,操作②包含的步骤有蒸发浓缩、???▲????、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称?▲??,需要测定的数据有?????▲?????。
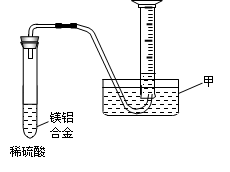
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+
的物质的量之和为0.10 mol,若向此溶液加入170 mL? 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为???▲???mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。?
参考答案:(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:略
本题难度:一般
5、选择题 下列关于各实验装置图的叙述中正确的是( )。
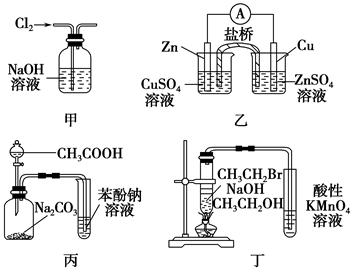
A.图甲:除去Cl2中含有的少量HCl
B.图乙:构成锌—铜原电池
C.图丙:根据实验现象推知酸性CH3COOH>H2CO3>C6H5OH
D.图丁:验证溴乙烷发生消去反应生成烯烃
参考答案:C
本题解析:氯气也会被NaOH溶液吸收,A错误;左池中应加可溶性锌盐,右池中加可溶性铜盐才能构成原电池,B错误;醋酸与Na2CO3反应生成CO2,CO2通入苯酚钠溶液生成苯酚,根据“强酸制弱酸”的原则,可得出结论,C正确;乙醇易挥发,挥发出的乙醇也能使酸性高锰酸钾溶液褪色,D错误。
本题难度:一般
|
|