微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
A.溶液中钡离子数目减小
B.溶液中钡离子浓度减小
C.溶液中氢氧根离子浓度增大
D.pH值减小
参考答案:A
本题解析:
【错解分析】本题的另一错解是:当平衡发生移动时,一定会引起相应物质的数量变化。若是讨论某个具体物质的数量,它应该绝对变化,如溶质微粒个数,溶质质量和溶液质量等。但若讨论两个量的比值,在特定条件下可能不变,如溶解度,浓度等。本题讨论溶解平衡(分散系是悬浊液),其溶液为饱和溶液。温度不变时,各种离子的浓度保持不变,选项B、C、D皆与浓度有关,因此不变。而选项A中的钡离子的个数,随着水的量的减少,溶液质量、溶质质量都相应减少,其个数必然减少。
【正解】任何事物都存在矛盾的两个方面,在氢氧化钡溶解平
本题难度:简单
2、选择题 取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为???????????????????????????????????????????????(????)
A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L
参考答案:C
本题解析:考查pH的有关计算。根据题意氢氧化钠过量,反应后溶液中OH-的浓度为0.01mol/L。所以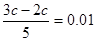 ,解得c=0.05mol/L。答案是C。
,解得c=0.05mol/L。答案是C。
本题难度:简单
3、选择题 常温时,下列三种溶液:
①0.001 mol·L-1氨水与0.001 mol·L-1 HCl溶液等体积混合液
②pH=3的HCl与pH=11的NaOH溶液等体积混合液
③pH=11的氨水与pH=3的HCl溶液等体积混合液。
其pH大小关系正确的是(??)
A.①=②=③
B.①>②=③
C.①<②=③
D.①<②<③
参考答案:D
本题解析:①中两者恰好反应生成氯化铵,溶液的pH<7;②中盐酸与氢氧化钠恰好完全反应,溶液的pH=7;③中氨水是弱碱,反应后过量,溶液的pH>7,故选项D符合。
本题难度:一般
4、选择题 常温下,向20mL 0.1mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是

A.VNaOH=10mL时,溶液中存在C(Na+)=2C(H2T)+2C(H T—)+2C(T 2—)
B.VNaOH=20mL时,溶液中存在C(Na+)>C(HT—)>C(H+)>C(H2T)>C(T 2—)
C.VNaOH=30mL时,溶液中存在C(Na+)>C(HT—)>C(T 2—)>C(OH—)>C(H+)
D.VNaOH=40mL时,溶液中存在C(OH—)=C(HT—)+2C(H2T)+C(H+)
参考答案:D
本题解析:
试题分析:当VNaOH=10mL时,溶液中的溶质是NaHT和H2T,所以根据原子守恒可知,选项A不正确,应该是2C(Na+)=C(H2T)+C(H T—)+C(T 2—);当VNaOH=20mL时,溶液中的溶质是NaHT,根据图像可知溶液显酸性,这说明水解程度小于电离程度,所以应该是C(Na+)>C(HT—)>C(H+)>C(T 2—) >C(H2T),B不正确;VNaOH=30mL时,溶液中的溶质是NaHT和Na2T,同样根据图像可知溶液显酸性,所以C(Na+)>C(T 2—) >C(HT—)>
本题难度:简单
5、选择题 化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键。下列能量转换过程,不涉及化学变化的是
A.利用氢氧燃料电池提供电能
B.利用太阳能分解水制备氢气
C.利用水流驱动涡轮机发电
D.利用植物秸秆为原料生产乙醇燃料
参考答案:C
本题解析:
试题分析:A.利用氢氧燃料电池提供电能是化学能转化为电能,涉及化学变化,错误;B.利用太阳能分解水制备氢气是光能转化为化学能,涉及化学变化,错误;C.利用水流驱动涡轮机发电是机械能转化为电能,不涉及化学变化,正确;D.利用植物秸秆为原料生产乙醇燃料是发生化学变化,错误。
考点:考查物质转化关系过程中的能量变化的知识。
本题难度:一般