微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1 的叙述错误的是
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2 和液态水时放出热量5 800 kJ
D.该反应为丁烷燃烧的热化学方程式,则丁烷的燃烧热为5800 kJ·mol-1
参考答案:D
本题解析:
试题分析:A、根据题意得出该反应的反应热△H=-5800kJ/mol,是放热反应,正确,不选;B、反应热的与物质的状态有关,因此书写热化学方程式物质的状态必须写上,同时反应热跟方程式的系数对应,正确,不选;C、热化学方程式不仅表明了化学反应的物质的变化,也表明了化学反应的能量变化,正确,不选;D、燃烧热:在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。C4H10系数不是1,5800 kJ·mol-1不是丁烷的燃烧热,错误,选D。
考点:考查反应热、热化学反应方程式的书写、燃烧热等相关知识。
本题难度:一般
2、选择题 甲溶液的pH是4,乙溶液的pH是5,则甲溶液与乙溶液的c(OH-)之比为
A.4∶5
B.1∶10
C.10∶1
D.1∶2
参考答案:B
本题解析:
甲溶液与乙溶液的c(OH-)之比为(KW/10―4?):(KW/10―5?)=1:10故B正确。
本题难度:一般
3、选择题 下列叙述正确的是?????????????????????????????????????????????????????????????????????????????? ???????(???)
A.向CH3COONa的稀溶液中加入少量CH3COONa晶体,则溶液中的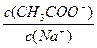 比值变大
比值变大
B.体积为VL的Na2CO3溶液pH=a,加水后使其体积为10V时,其溶液的pH=a-1
C.pH=11的KOH溶液与pH=3的醋酸溶液等体积混合,滴入酚酞后溶液呈红色
D.硫酸铵溶液中加入适量氨水,当溶液的pH=7时,c(SO2-4)>c(NH+4)
参考答案:A
本题解析:醋酸钠溶液中加入少量醋酸钠晶体,溶液浓度会增大,醋酸根离子浓度与钠离子浓度的比值等于醋酸根离子物质的量与钠离子物质的量之比,应分子分母均变化不一比较。变换思维,向醋酸钠溶液中加入少量水,溶液浓度会变稀,醋酸根离子的水解程度增大,分母钠离子的物质的量不变,分子醋酸根离子的物质的量减小,分式的值减小。相反增大浓度分式的值增大。
本题难度:一般
4、选择题 取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为???????????????????????????????????????????????(????)
A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L
参考答案:C
本题解析:考查pH的有关计算。根据题意氢氧化钠过量,反应后溶液中OH-的浓度为0.01mol/L。所以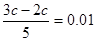 ,解得c=0.05mol/L。答案是C。
,解得c=0.05mol/L。答案是C。
本题难度:简单
5、填空题 (6分)(1)常温下将0.2 mol/LHCl溶液与0.2 mol/LMOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)__________0.2 mol/LHCl溶液中由水电离出的c(H+);(填“>”“<”或“=”)
(2)常温下若将0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度;(填“>”“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH__________。(填“>7”“<7”或“无法确定”)
参考答案:(1)>? (2)<?? (3)<7
本题解析:(1)0.2 mol/LHCl溶液与0.2 mol/LMOH溶液等体积混合,说明酸碱恰好反应。混合溶液的pH=6,说明水解显酸性,水解促进电离,所以答案是“>”。
(2)0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合,说明MOH过量,即混合液是由等量的MOH和MCl混合而成的。混合溶液的pH<7,说明MCl的水解程度大于MOH的电离程度。
(3)如果RH是强酸,则显中性。如果是弱酸,则RH过量,溶液显酸性,是由答案是“<7”。
本题难度:一般