微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应I2(g)+H2(g)  2HI(g)? ΔH<0,下列说法正确的是( )
2HI(g)? ΔH<0,下列说法正确的是( )
A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数
B.升高温度将缩短达到平衡的时间
C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大
D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小
参考答案:B
本题解析:
试题分析:根据方程式可知,该反应是体积不变的放热的可逆反应,降低温度,正向反应速率减小倍数小于逆向反应速率减小倍数,平衡向正反应方向移动,A不正确;升高温度,反应速率增大,将缩短达到平衡的时间,B正确;达到平衡后,保持温度和容积不变,充入氩气,浓度不变,正、逆反应速率均不变,平衡不移动,C不正确;达到平衡后,保持温度和压强不变,充入氩气,容器的容积必然增大,但平衡不移动,HI的质量不变,D不正确,答案选B。
点评:该题是中等难度的试题,试题贴近高考,针对性强,有利于培养学生的逻辑推理能力和发散思维能力。该题的易错点是选项CD,注意压强对反应速率和平衡状态影响的实质。
本题难度:简单
2、选择题 对可逆反应A(g)+B(g)===C(g) ΔH>0,下列图像正确的是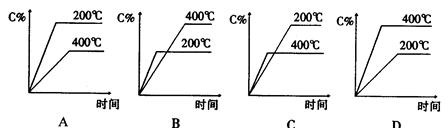
参考答案:D
本题解析:根据方程式可知,该反应是体积减小的、吸热的可逆反应。所以升高温度,平衡向正反应方向移动,C的含量增大。温度高,反应速率快,达到平衡的时间就少,所以选项D是正确的,答案选D。
本题难度:一般
3、选择题 在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:
A(气)+xB(气)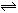 2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
2C(气),2min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是
A.平衡时,物质的量比A∶B∶C=2∶11∶4
B.x值等于4
C.A的转化率20%
D.B的平均反应速率为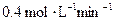
参考答案:BC
本题解析:略
本题难度:一般
4、选择题 在体积固定为2 L的密闭容器中,A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化情况如图甲所示。下列有关说法不正确的是
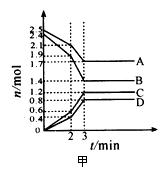
A.该反应的化学方程式为4A + 5B 6C + 4D
6C + 4D
B.前2 min用B表示的反应速率约为0.0021 mol·L-1·s-1
C.2 min时,外界条件的改变可能是升高温度或加入了催化剂
D.若起始时只加入A、B且物质的量分别为1.6 mol和2.0 mol,则达平衡时A、B的转化率不相等
参考答案:D
本题解析:略
本题难度:一般
5、简答题 (本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
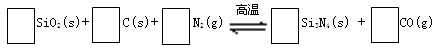
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是???????????????,其还原产物是??????????????。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
 ???????????
???????????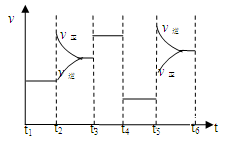
32.该反应的平衡常数表达式为K=??????????????。升高温度,其平衡常数??????(选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是??
????????????????,t3引起变化的因素为?????????????????????????,t5时引起v逆大变化、v正小变化的原因是???????????????????????????????????。
参考答案:
 本题解析:
本题解析:
试题分析:30、该反应中碳化合价由0价到+2,氮元素由0价变为-3价,氮气为氧化剂,氮化硅为还原产物;31、催化剂不改变反应能量变化但可以降低反应活化能,即起点、终点与原图像一致,波峰的高度比原图像低;32、由图确定该反应为放热反应,升高温度平衡逆向移动,平衡常数变小;33、t2时图像逆反应速率没变,正反应速率增大应为增加气态反应物浓度,t3时反应速率增大,平衡不移动,(而且方程式化学计量数不等不是压强改变)应该是使用正催化剂;t5时反应速率均增大,且逆反应速率大于正反应速率,应为升高温度或缩小容器体积增大压强。
本题难度:一般