微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 对于CO(g)+H2O(g) CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
2、选择题 在容积可变的密闭容器中,10 mol N2和30 mol H?2在一定条件下反应,达到平衡时,H2的转化率为25%,则平衡时氨气的物质的量为( )
A.2.5 mol
B.4.5 mol
C.5mol
D.7.5 mol
3、计算题 在合成氨时,将100mol氮气和300mol氢气混合后通过合成塔中的催化剂,一定条件下达到平衡时,若测得混合气体中氨气的含量为25%。求平衡混合气体中N2的体积分数和H2的转化率各为多少?
4、选择题 一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)  2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓 度不再发生变化
度不再发生变化
③容器中的压强不再发生变化 ????? ④单位时间内生成n mol Z,同时生成2n mol Y
A.①②
B.①④
C.②③
D.③④
5、填空题 工业合成氨反应:N2+3H2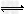 2NH3?,在一定条件下已达到平衡状态。
2NH3?,在一定条件下已达到平衡状态。
⑴若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2?kJ·mol-1,则该反应的热化学方程式为________________。
⑵若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n(NH3)=0.8mol,则反应速率v?(N2)=__________mol/(L·min),H2的转化率=____________,平衡常数=____________。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡___________(填向左﹑向右或不移动)移动。
⑶若在恒温恒压条件下,将1?molN2与3?molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a?molNH3,这时N2的物质的量为___________mol(用含a的代数式表示);若开始时只通入N2与H2?,达平衡时生成3amolNH3,则开始时应通入N2?3mol,H2?=?___________mol(平衡时NH3?的质量分数与前者相同);若开始时通入x?molN2﹑6molH2?和2mol?NH3,达平衡后,N2和NH3的物质的量分别为y?mol和3a?mol,则x=?________mol,y=__________mol(用含a的代数式表示)。