微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某化学课外小组设计了如下图(铁架台均已略去)所示的实验装置,进行气体性质实验。图中用箭头表示气体流向,A表示一种纯净、干燥的气体,B表示另一种气体。反应进行一段时间后,装置己中有红棕色气体生成。实验中所用的药品和干燥剂只能从下列物质中选取:N a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
a2CO3、NaHCO3、MnO2、Na2O2、NaCl、无水CaCl2、NH4HCO3、碱石灰等固体和H2O2、蒸馏水。
根据图中装置和反应现象请回答:
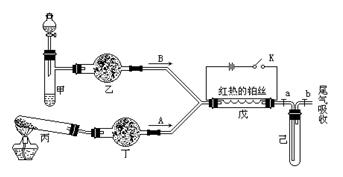
(1)丙中发生反应的化学方程式为????????????????????????????????。
(2)丁中的干燥剂应选???????,不选另一种干燥剂的理由是?????????????????????????????????????。
(3)甲中发生反应的化学方程式为?????????????????????????????????? ????。
????。
(4)戊中发生的主要反应的化学方程式为?????????????????????????,此反应是(吸热、放热)???????反应,可能发生的什么现象可以证明你的判断??????????????。
参考答案:(1)NH4HCO3 本题解析:略
本题解析:略
本题难度:一般
2、实验题 镁是很活泼的金属,常用作脱硫剂、脱氧剂。在电子工业中用镁制取硅的反应为:2Mg+SiO2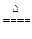 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si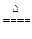 Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4,SiH4在常温下是一种不稳定、易分解的气体(燃烧热约为1430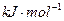 )。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
)。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:
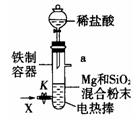
(1)由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气。X气体应选用①CO2、②N2、③H2中的????????????。
(2)当接通电源引发反应后,切断电源,反应能继续进行,其原因是??????????????
??????。证明了反应物Mg与SiO2具有的总能量?????????(填“大于”、“小于”或“等于”)生成物MgO和Si具有的总能量。
(3)反应结束时,待冷却至常温后,关闭K,从分液漏斗中加入稀盐酸,可观察到导管口a处有闪亮的火星。据此现象可推知???????在空气中能自燃。燃烧的热化学方程式为
??????????????????????????????????????????,当产生等量的热量时,燃烧CH4和SiH4的物质的量之比为???????????(CH4的燃烧热是890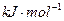 )
)
参考答案:(1)H2(或③)??
(2)该反应为放热反应???大
本题解析:略
本题难度:一般
3、实验题 实验室制取SO2的反应原理之一为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率
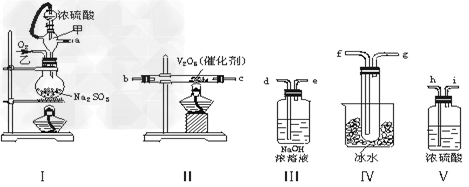
(1)这些装置的连接顺序(按气体左右的方向)是____→____→____→____→____→____→?____→?____→____(填各接口的编号)。
(2)实验时甲橡胶管的作用与原理是________________?。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____________。
(4)Ⅳ处观察到的现象是____________。
(5)用n?mol?Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m?g,则本实验中SO2的转化率为________。
参考答案:(1)a??h??i??b??c??f??g??d?
本题解析:
本题难度:一般
4、实验题 (9分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g.
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察______.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成_____________________色.
(2)滴定结果如下表所示:
滴定次数
| 待测溶液的体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 0.20
| 20.20
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________.
参考答案:(1)①偏高 ②无影响 ③B ④无 粉红(或浅红)(2)18
本题解析:(1)①碱式滴定管如果没有用标准液润洗,则氢氧化钠溶液的浓度将变小,则消耗氢氧化钠溶液的体积偏大,测定结果偏高;
②锥形瓶只能用蒸馏水润洗,所以不影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,答案选B;
④滴定达到终点的判断是当加入最后一滴,溶液有无色变成粉红(或浅红)色,且30s不变色。
(2)三次实验中消耗的氢氧化钠溶液的体积分别是20.01ml、19.99ml、20.00ml,所以三次的平均值为20.00ml,所以25.00mL溶液中氢离子的物质的量为0.02L×0.1010mol/L=0.00202mol。则原溶液中氢离子的物质的量为0.00202mol×10=0.0202mol,所以NH4+的物质的量也是0.0202mol。因此该样品中氮的质量分数为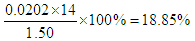 。 。
本题难度:一般
5、实验题 (16分)黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示:

已知:①王水是由1体积的浓硝 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
________________________________________________________________。
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是_________(填代号)
A.BaCl2
B.NaOH
C.Na2SO4
D.HCl
(4)实验室利用下列装置和试剂制取少量氯化氢气体试剂:①浓硫酸 ②浓盐酸 ③食盐固体

若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
若选用试剂①②,则宜选择的装置是____________。
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
参考答案:(16分,每空2分)
(1)用量筒取3体积的浓盐酸倒入
本题解析:略
本题难度:一般
|