微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2 (g)+3B2 (g)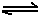 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
参考答案:
(1)第二周期ⅤA族
(2)H3O
本题解析:
试题分析:根据题意得出A、B、C、D、E元素分别为O、H、Na、N、Al。(2)结合质子(H+)的能力不同,可以通过一种物质把另一种物质中结合的质子夺走来加以证明;(3)A、D、E三种元素形成的盐为Al(NO3)3,铝离子水解溶液呈酸性;(4)常温下0.1mol·L—1W的水溶液的pH为13,即氢氧根离子浓度为0.1mol·L—1,确定为一元强碱溶液,故为A为NaOH;Q的水溶液呈酸性且能和W反应放出气体,确定为NH4NO3;(6)A、平衡状态的标志,正逆反应速率相等,正确;B、温度不变,平衡常数不变,错误;C、反应为放热反应,升高温度平衡逆向移动,平衡常数变小,反应物转化率降低,错误;D、在达到平衡的过程中,随反应进行气体的物质的量变少,但总质量不变,摩尔质量变大,错误。
考点:考查物质结构与平衡的有关问题。
本题难度:困难
2、选择题 汽车尾气净化中的一个反应如下:NO(g)+CO(g)= N2(g)+CO2(g) ΔH=-373.4KJ/mol
N2(g)+CO2(g) ΔH=-373.4KJ/mol
若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是
A.其它条件不变,加入催化剂,ΔH变大
B.及时除去二氧化碳,正反应速率加快
C.降低温度,可提高反应物的转化率
D.若气体的密度保持不变,说明平衡不发生移动
参考答案:C
本题解析:
试题分析:A.其它条件不变,加入催化剂,反应速率改变,但是ΔH不变,错误;B.及时除去二氧化碳,即减小生成物的浓度,平衡正向移动,正反应速率由于生成物的浓度减小,所以正反应速率减慢,错误;C.降低温度,平衡向放热的正反应方向移动,因此可提高反应物的转化率,正确;D.由于反应是在恒温、恒容的密闭容器中进行,反应前后气体的质量不变,所以在任何时刻都存在气体的密度不变,因此气体的密度不变,不能说明平衡不发生移动,错误。
考点:考查化学反应速率、化学平衡及物质的转化率的影响的知识。
本题难度:一般
3、填空题 (14分)(1)二氧化硫的催化氧化的过程如图所示,
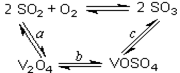
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
压强/MPa
温度/℃
| 0.1[
| 0.5
| 1
| 10
|
400
| 99.2%
| 99.6%
| 99.7%
| 99.9%
|
500
| 93.5%
| 96.9%
| 97.8%
| 99.3%
|
600
| 73.7%
| 85.8%
| 89.5%
| 96.4%
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图所示。图中t1 时引起平衡移动的条件可能是 其中表示平衡混合物中SO3的含量最高的一段时间是 。

(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K= 。 2SO2+O2 在550 ℃时的平衡常数K= 。
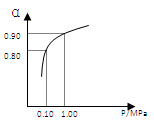
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
参考答案:(1)V2O5 (2)增大压强、t2—
本题解析:(1)将abc三个反应相叠加,即得到2SO2+O2 2SO3,因此V2O5其催化剂作用。 2SO3,因此V2O5其催化剂作用。
(2)t1 时正逆反应速率都增大,但正反应速率大于逆反应速率,说明平衡向正反应方向移动,所以改变的条件是增大压强。由于t3时逆反应速率大于正反应速率,平衡向逆反应方向移动,所以平衡混合物中SO3的含量最高的一段时间是t2—t3。
(3)反应达平衡后,体系总压强为0.10 M Pa,此时转化率是0.80,所以生成三氧化硫是1.6mol,则平衡时二氧化硫和氧气分别是0.4mol、0.2mol,所以平衡常数K= ,则反应2SO3 ,则反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=1/400=0.0025。反应是放热反应,所以升高温度平衡向逆反应方向移动,n(SO3)/n(SO2)减小。充入He(g),使体系总压强增大,但物质的浓度不变,所以平衡不移动。C、D都相当于增大压强,平衡向正反应方向移动,所以n(SO3)/n(SO2)增大,答案选CD。 2SO2+O2 在550 ℃时的平衡常数K=1/400=0.0025。反应是放热反应,所以升高温度平衡向逆反应方向移动,n(SO3)/n(SO2)减小。充入He(g),使体系总压强增大,但物质的浓度不变,所以平衡不移动。C、D都相当于增大压强,平衡向正反应方向移动,所以n(SO3)/n(SO2)增大,答案选CD。
(4)根据电荷守恒c(NH4+)+c(H+)= 2c(SO42-)+c(OH-)可知,当溶液显中性时c(NH4+)= 2c(SO42-)=ymol/L。根据氮原子守恒可知,溶液中c(NH3·H2O)=(x/2-y)mol,所以平衡常数=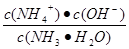 =2×10-7y /(x-2y)。 =2×10-7y /(x-2y)。
本题难度:困难
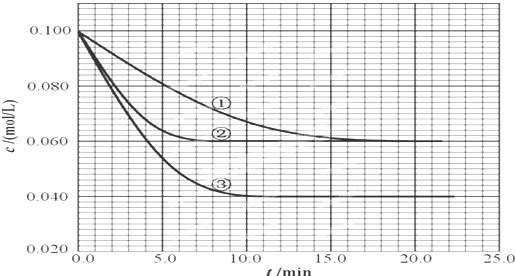
4、简答题 在2.00L的密闭容器中,反应2A(g)?B(g)+C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L.反应物A的浓度随时间的变化如下图所示:
请回答下列问题:
(1)以下说法能说明该反应已达到平衡状态的是:______(填序号)
①c(A):c(B):c(C)=2:1:1
②v(A)=2v(B)
③体系的压强不再改变
④A的质量分数不再改变
⑤混合气体的密度不再改变
(2)根据实验③回答:反应开始到4.0min时反应物A的转化率为______,B平均反应速率为______.
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②______;③______.
(4)实验①条件下该反应的化学平衡常数值是______.若实验①到达平衡后,维持体系温度不变,往容器中再投入0.028molB和0.028molC,求新平衡时体系中A的物质的量浓度.(写出计算过程)
参考答案:(1)①平衡时各物质的物质的量的多少取决于起始量与转化的程度
本题解析:
本题难度:一般
5、选择题 |
|
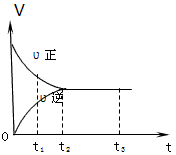
下图是可逆反应X2+3Y2 2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是
 [???? ]
[???? ]
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
参考答案:BD
本题解析:
本题难度:一般