0.1
下列说法错误的是
A.反应在第2 min到第4min时,O2的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1
参考答案:BD
本题解析:
试题分析:先由△c÷△t的定义式直接求v(NH3)或v(NO),再由系数比规律间接求v(O2),则v(O2)="0.3mol/L÷2min×5/4=0.1875" mol/(L·min),故A正确;催化剂能加快反应速率,使c(NH3)的消耗速率增大,虽然升温也能加快反应速率,但也能使平衡左移,使c(NH3)增大,故B错误;第4 min时、第8 min时分别达到化学平衡,由于c(H2O)=6c(NO)/4,则平衡常数分别为(0.54×0.756)/(0.34×0.9755)、(0.14×0.156)/(0.74×1.4755),前者大于后者,故C正确;在开始反应的前2 min内,△c(NH3)=0.2mol/L,则消耗0.2mol NH3,设放出的热量为xkJ,所以4/0.2=Q/x,则x=0.05Q,因此该反应的△H仍是-Q kJ·mol-1,故D错误。
考点:考查化学反应速率的计算、影响化学反应速率和化学平衡的因素、化学平衡常数的计算、化学反应的焓变与热量变化等知识。
本题难度:简单
2、填空题 亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
_____Na2SO3+____KIO3+____ H2SO4=____Na2SO4 +_____K2SO4+____ I2 +_____H2O
(1)配平上面的氧化还原反应方程式,将化学计量数填在空白处。
(2)其中氧化剂是_______,若反应中有5mol电子转移,则生成碘_______mol。
(3)该反应过程和机理较复杂,一般认为分以下①~④步反应:
①IO3-+SO32- =IO2-+SO42- (反应速率慢)
②IO2-+2SO32- =I-+2SO42- (反应速率快)
③5I-+6H++IO3-=3I2+3H2O (反应速率快)
④I2+SO32- +H2O=2I-+SO42- +2H+ (反应速率快)
根据上述条件推测,此反应总的反应速率由__________步反应决定(填上述四步反应的序号)。
(4)若预先加入淀粉溶液,由题述看必须在___________离子消耗完时,才会有使淀粉变蓝的现象产生。
参考答案:(1)5 、2 、1 、5 、1 、1 、1
(2)K
本题解析:
本题难度:一般
3、实验题 催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察?????????????????????????????,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论________(填“合理”或“不合理”),理由是______________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是??? ????????。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。

①实验时放出气体的总体积是???????????mL。
②放出1/3气体所需时间为 ??????????min。
③计算H2O2的初始物质的量浓度_____________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑤?解释④反应速率变化的原因? ___???????????????????????? _____。
参考答案:(共14分)
(1)产生气泡的快慢(2分),?不合理(
本题解析:
试题分析:(1)甲中催化剂不同,则可以通过产生气泡的快慢定性比较得出结论。由于加入的盐中阴离子不同,所以不能通过观察甲中两支试管产生气泡的快慢,得出Fe3+和Cu2+对H2O2分解的催化效果。
(2)要比较外界条件对反应速率的影响,则需要测定产生40mL气体所需的时间来进行定量测定和计算。
(3)①根据图像可知,实验时放出气体的总体积是60ml。
②放出1/3气体大约是20ml,所需时间为1min。
③最终生成氧气的体积是60ml,物质的量是0.06L÷22.4L/mol=
本题难度:一般
4、选择题 可逆反应2SO2(g)+O2(g)
参考答案:
本题解析:
本题难度:一般
5、简答题 某化学兴趣小组为了研究在溶液中进行的反应A+B═C+D的反应速率,他们将A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的曲线.据此,请完成以下问题:
(1)在0~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的时间段是______,生成C的量最多的时间段是______.
(2)从反应速率的变化,可看出该反应可能是______反应(填“放热”或“吸热”).
(3)在t4后,C的浓度不再变化的原因可能是______.根据你的分析,定性地画出该反应的速率随反应时间的变化曲线(有几种情况画几种坐标图).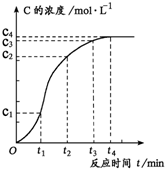
参考答案:(1)分析图象可知:t1~t2时间段里,C的物质的量浓度的变
本题解析:
本题难度:一般
|