微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一个真空容器中盛有1 mol PCl5,加热到200 ℃时发生如下反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡后,PCl5的体积分数为M%,若在同一温度和同一容器中最初投入2 mol PCl5,反应达到平衡时,PCl5的体积分数为N%,则M和N的正确关系为(???)
PCl3(g)+Cl2(g),反应达到平衡后,PCl5的体积分数为M%,若在同一温度和同一容器中最初投入2 mol PCl5,反应达到平衡时,PCl5的体积分数为N%,则M和N的正确关系为(???)
A.M>N
B.N>M
C.M=N
D.无法确定
参考答案:B
本题解析:后者相当于在前者的基础上加压,达到平衡时,PCl5的体积分数会增大,所以选B。
本题难度:简单
2、选择题 反应A(g)+3B(g)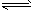 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
[???? ]
A.υ(D)=0.4 mol / (L·s)
B.υ(C)=0.5 mol / (L·s)
C.υ(B)=0.6 mol / (L·s)
D.υ(A)=0.15 mol / (L·s)
参考答案:B
本题解析:
本题难度:简单
3、选择题
FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl
Fe(SCN)3+3NH4Cl
所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A.向溶液中加入少量KCl晶体
B.向溶液中加入少量的水
C.向溶液中加入少量无水硫酸铜,变蓝后立即取出
D.向溶液中滴加2滴1 mol·L-1的FeCl3(aq)
参考答案:B
本题解析:从反应实质来看,溶液中存在的化学平衡是:
Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
等系列反应。可见加入 KCl 晶体,对此平衡无影响;但加入 2 滴 1 mol·L-1的 FeCl3(aq),使溶液中 Fe3+浓度增大,平衡则向正反应方向移动,溶液颜色变深。A、D 项皆不可选。
对于 B、C 选项,因平衡体系中的水量发生了改变,导致溶液中所有溶质的浓度或同等程度地增大,或同等程度地减小;若要判断平衡移动的方向,从浓度的改变来看,似无从下手。如果我们变换一下思路,将上列平衡体系中的 Fe3+、SCN-和 Fe(SCN)3均虚拟为气态物质(虚拟其状态),则向平衡体系中加水,可认为增大了容器的容积,即减小了气体反应物的压强(或浓度),平衡就向气体体积扩大的方向(即上列反应的逆反应方向)移动,这样液体颜色就会变浅。可见 B 项可选而 C 项不可选。
若采用极限思维,对于 B 选项,可作如下设想:加入的水不是很少而是很多,这样上列平衡体系中,Fe3+与 SCN-相互碰撞结合成 Fe(SCN)3分子的机会越稀越少,而 Fe(SCN)3分子电离成 Fe3+和 SCN-的机会则越来越多,无疑是加水的结果,平衡是向逆反应方向移动的,故而溶液颜色变浅。
本题难度:一般
4、选择题 有mA(g)+nB(g)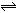 pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了
pC(g)+qD(g)反应,经10 min达到平衡,结果A的浓度减少了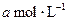 ,B的浓度减少了
,B的浓度减少了 ,C的浓度增加了
,C的浓度增加了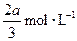 ,然后增大容器容积, A、 B、C的体积分数不变,则m∶n∶p∶q为( )
,然后增大容器容积, A、 B、C的体积分数不变,则m∶n∶p∶q为( )
A.1∶3∶2∶2 ? B.2∶3∶3∶2?? C.1∶3∶2∶1 ?D.3∶1∶2∶2
参考答案:D
本题解析:略
本题难度:一般
5、选择题 CO(g)+H2O(g) CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)△H<0在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.c2(CO)<c2(H2O)
B.c1(CO)>c2(CO)
C.K2和K1的单位均为mol/L
D.K2<K1
参考答案:
D
本题解析:
该考点为化学平衡知识,中等难度。因为△H<0,所以该反应为放热反应,升高反应体系的温度,平衡向逆反应方向移动,所以c1(CO)>c2(CO)错误,即B错误;平衡无论如何移动,c(CO)=c(H2O),所以A选项错误;根据平衡常数的表达式,该反应平衡常数无单位,C选项错误,选D。
本题难度:一般