微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列物质中,在一定条件下能与某些金属、非金属、酸、碱都反应的
A.Cl2
B.CO2
C.MgO
D.NaHCO3
参考答案:A
本题解析:
本题难度:简单
2、选择题 现有四种物质:NaHCO3溶液、NaOH溶液、盐酸、铁粉.它们两两之间发生的反应最多有
A.3个
B.4个
C.5个
D.6个
参考答案:B
本题解析:
本题难度:简单
3、选择题 下列物质中不能与钠发生反应的是
A.乙醇
B.乙酸
C.水
D.煤油
参考答案:D
本题解析:试题分析:乙醇、乙酸和水都和钠反应生成氢气,但煤油不能,钠一般保存在煤油中,答案选D。
考点:考查钠的性质
点评:该题是基础性试题的考查,试题注重基础,侧重对金属钠性质的考查,有利于巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力。该题难度不大,记住即可。
本题难度:困难
4、选择题 把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3:1,则原混合物中Fe2O3与Fe的物质的量之比为
A.1:1
B.2:5
C.4:1
D.3:1
参考答案:B
本题解析:分析:反应的方程式有:Fe+2HCl=FeCl2+H2↑,Fe2O3+6HCl=2FeCl3+3H2O,2FeCl3+Fe=3FeCl2,根据反应的方程式计算.
解答:设原混合物中含有xmolFe,ymolFe2O3,
Fe2O3+6HCl=2FeCl3+3H2O
y??????????2y????
2FeCl3+Fe=3FeCl2
2y???? y??? 3y
?? Fe+2HCl=FeCl2+H2↑
(x-y)??(x-y)? (x-y)
则:[3y+(x-y)]:(x-y)=3:1,
y:x=2:5,
故选B.
点评:本题考查化学方程式的相关计算,题目难度不大,注意根据方程式结合物质的性质计算.
本题难度:一般
5、选择题 25℃时,20.00mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466g沉淀.滤液跟2mol/l?NaOH溶液反应,共用去10.00ml碱液时恰好中和.下列说法中正确的是
A.原混合液中c(SO42-)=0.2mol/L
B.原混合液中c(NO3-)=0.9mol/L
C.原混合液中pH=0
D.原混合液中由水电离出的c(H+)=0.1mol/L
参考答案:C
本题解析:分析:根据反应SO42-+Ba2+=BaSO4↓可计算H2SO4的物质的量,根据反应H++OH-=H2O可计算HNO3的物质的量,进而计算物质的量浓度和溶液的pH.
解答:由题意可知0.466g沉淀为BaSO4,n(BaSO4)=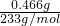 =0.002mol,n(H2SO4)=0.002mol,
=0.002mol,n(H2SO4)=0.002mol,
滤液跟2mol/lNaOH溶液反应,共用去10.00ml碱液时恰好中和,
则由反应H++OH-=H2O可知,n(H+)=n(NaOH)=0.01L×2mol/L=0.02mol,
则n(HNO3)=0.02mol-2×0.002mol=0.016mol,
则c(SO42-)=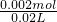 =0.1mol/L,
=0.1mol/L,
c(NO3-)=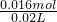 =0.8mol/L,
=0.8mol/L,
n(H+)=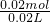 =1mol/L,
=1mol/L,
pH=0,
原混合液中由水电离出的c(H+)=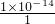 mol/L=1×10-14mol/L,
mol/L=1×10-14mol/L,
故选C.
点评:本题考查混合物的计算,题目难度不大,注意根据有关反应的方程式,计算时注意从守恒的角度思考.
本题难度:困难