微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应A2(g)+2B2(g)?2AB2(g)(正反应为放热反应),下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度,有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
参考答案:升高温度,正逆反应速率都增大,可缩短得到平衡所用时间,则A错
本题解析:
本题难度:简单
2、简答题 下表数据是某科研机构在某温度下测得的金属镁、锌和镍分别在氧气中进行氧化反应时,金属表面生成氧化物薄膜的实验数据记录:
| 反应时间t(h) | 1 | 4 | 9 | 16 | 25
MgO膜厚Y(nm)
0.02a
0.08a
0.18a
0.32a
0.50a
ZnO膜厚Y(nm)
1.0×10-3b
4.0×10-3b
9.0×10-3b
1.6×10-2b
2.5×10-2b
NiO膜厚Y(nm)
0.3c
0.6c
0.9c
1.2c
1.5c
(说明:a、b、c均为与温度有关的常数)
请回答下列问题:
(1)根据表中数据,分别建立金属氧化物的膜厚Y与时间t的函数关系式:
MgO:______;ZnO:______.
(2)金属在一定温度下氧化腐蚀速率可以用金属氧化物薄膜的生长率来表示,计算金属锌在此高温下1-25h内的氧化腐蚀速率.氧化腐蚀速率:______.
(3)为了比较三种金属的氧化腐蚀速率,实验中除了要控制相同的温度外,还应该控制的变量是______.
(4)根据表中数据绘出NiO膜厚与时间的关系曲线:
(5)综合以上信息,判断三种金属中哪种金属具有更良好的耐腐蚀性:______.
参考答案:(1)由表中数目可知MgO膜厚Y是时间的0.02a倍,膜厚Y
本题解析:
本题难度:一般
3、选择题 在一定温度时,N2与H2反应过程中能量变化的曲线如图。
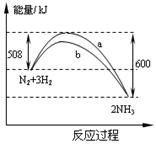
下列叙述正确的是(???)
A.该反应的热化学方程式为:N2+3H2 2NH3ΔH = -92 kJ/mol 2NH3ΔH = -92 kJ/mol
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的放热增多
D.加入催化剂可增大正反应速率,降低逆反应速率
参考答案:B
本题解析:略
本题难度:一般
4、选择题 一定条件下,CO与H2反应可生成乙醇:2CO+4H2?CH3CH2OH+H2O.下列关于该反应的说法错误的是( )
A.升高体系温度能增大反应速率
B.增大CO的浓度能减小反应速率
C.使用合适的催化剂可增大反应速率
D.若反应在密闭容器中进行,H2和CO不能全部转化为产物
参考答案:A.升高温度,可增大活化分子的百分数,反应速率增大,故A正确
本题解析:
本题难度:简单
5、实验题 甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/?盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
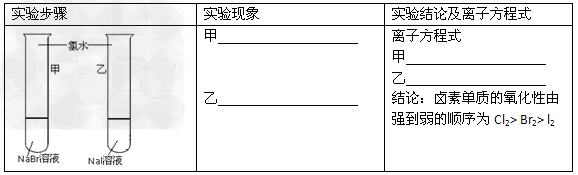
【评价】甲同学设计的实验方案的合理性是___________(填序号)
A.?非常合理 B.?部分合理 C.?完全不合理
【补充和完善】上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素

甲同学所得实验依据和结论有明显问题,问题是__________。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
①
②电极反应式 ____________________________、____________________________
参考答案:(1)![]() 本题解析: 本题解析:
本题难度:一般
|