微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (7分)某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见图,请分析实验过程:
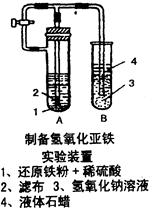
(1)在B试管中加入NaOH溶液后加热煮沸l-2分钟并立即加入2mL液体石蜡,上述操作目的是???????????????????????????????????。
(2)在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉要过量???????????????????????????????????????。
(3)连接好导管,同时打开活栓,当铁粉与稀硫酸反应平稳时,关闭活栓,这时看到A试管中???????????????????????(填现象),B试管中??????????????????????????(填现象)。
(4)如果B中产生的氢氧化亚铁遇到空气,发生变化的化学方程式为__________________??? ____。
参考答案:(1)加热煮沸是为了驱除溶在NaOH溶液中的氧气( 1分),
本题解析:(1)制取氢氧化亚铁重点是隔绝氧气、防止氧化;
(2)通过反应2Fe3++Fe=3Fe2+来保证溶液为纯净的亚铁盐
(3)先用产生的氢气排除系统内的氧气,再关闭活塞,溶液由A中被压入B试管中,产生沉淀
(4)4Fe(OH)2+O2+2H2O==4Fe(OH)3??( 2分)
本题难度:一般
2、计算题 (16分). 铜是人类最早知道的金属之一,实验室可用C、H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ. ?实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
(1)上述实验中C????????(填“完全”或“不完全”)参加反应,实验中收集到的气
体是?????(填写化学式),产生这种气体的化学方程式为:?????????????。
(2)反应后得到的固体混合物总质量为?????????????????,其中含氧化合物的物质的量为????????????mol。
Ⅱ. ??黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m?g?X粉末全部溶于200?mL的浓HNO3,反应后的溶液加水稀释至?2.12?L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/LBa(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
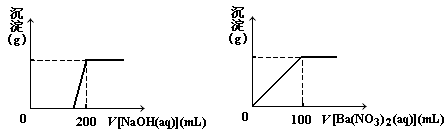
(1)?请通过计算确定m的值;?
(2)?X的摩尔质量为368 g/mol,请确定X的化学式。
参考答案:Ⅰ⑴不完全(1分);CO(1分);CO2+C高温
本题解析:Ⅰ(1)560ml气体是CO,物质的量是0.025mol。生成CO的方程式是CO2+C高温2CO 或 CuO+C高温Cu+CO↑。沉淀是碳酸钙,物质的量是0.025mol,则生成的CO2也是0.025mol。由于碳的物质的量是0.1mol,所以实验中碳没有完全参加反应。
(2)与碳原子结合的氧原子的物质的量是0.025mol+0.025mol×2=0.075mol,质量是12.g,所以最终固体的质量是8g-1.2g+1.2g-0.6g=7.4g。原氧化铜中氧原子的物质的量
本题难度:一般
3、选择题 (2009陕西西安八校联考,11)现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除 、Cl-外,还含有的金属阳离子是(???)
、Cl-外,还含有的金属阳离子是(???)
A.Zn2+、Cu2+、Fe3+
B.Zn2+、Fe2+、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe2+
D.Zn2+、Fe3+
参考答案:C
本题解析:本题考查反应的先后顺序问题。利用金属活动顺序表解决问题。假设CuSO4、FeCl3、Zn的物质的量各为1 mol。
2Fe3++ Zn====2Fe2++Zn2+
1 mol?? 0.5 mol
Cu2++ Zn====Cu+Zn2+
0.5 mol? 0.5 mol
所以溶液中含有的金属离子为Zn2+、Cu2+、Fe2+。
本题难度:一般
4、选择题 为测定某一铁矿石样品中的铁元素的质量分数,取3.702 g该铁矿石(铁以Fe2O3形式存在,其余物质不含铁)溶于浓热盐酸中,稀释至250 mL,从中取出25 mL溶液,作如下处理:加入过量的氨水,使铁以氢氧化铁的形式沉淀,将沉淀过滤,洗净并灼烧,使之完全转化为氧化铁。有关实验数据:坩埚质量:15.286 1 g;第一次灼烧后坩埚和固体的质量:15.620 9 g;第二次灼烧后坩埚和固体的质量:15.620 5 g;第三次灼烧后坩埚和固体的质量:15.620 5 g,则铁矿石中的铁元素的质量分数为(???)
A.63.2%
B.90.3%
C.6.32%
D.34.4%
参考答案:A
本题解析:此题主要考查实验数据分析及计算能力。经分析第一次灼烧后坩埚和固体的质量:15.620 9 g不能用,所以氧化铁的质量=15.620 5 g-15.286 1 g=0.334 4 g,所以铁矿石样品中Fe2O3的质量=3.344 g,铁元素的质量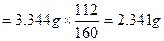 ,铁元素的质量分数
,铁元素的质量分数 本题难度:一般
本题难度:一般
5、选择题 将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是
A.硫酸
B.氯水
C.硝酸锌
D.溴水
参考答案:A
本题解析:
试题分析:铁屑溶于过量盐酸后上层氯化亚铁,稀硫酸和氯化亚铁不反应;氯水能把氯化亚铁氧化上层氯化铁;在酸性条件下,硝酸盐具有强氧化性,即硝酸锌能把氯化亚铁氧化,生成铁离子;另外溴水也具有强氧化性,能把亚铁离子氧化生成铁离子,所以正确的答案选A。
点评:该题是中等难度的试题,试题贴近高考,注重基础知识的巩固,侧重能力的培养。该题的关键是明确在酸性条件下,硝酸盐的氧化性,特别是在离子共存中经常出现,有利于培养学生的发散思维能力。
本题难度:简单