微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,BaCl2溶液呈中性,溶液中存在平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
A.向溶液中加入稀氨水,平衡逆向移动,c(OH-)降低,Kw不变
B.向溶液中加入少量固体CuSO4,c(H+)增大,Kw不变
C.向溶液中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低,Kw不变
D.将溶液加热到90℃,Kw增大,溶液仍呈中性,pH不变
参考答案:B
本题解析:
本题难度:一般
2、选择题 25℃时,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为A mol·L-1和 Bmol·L-1,则A与B的关系为 [???? ]
A.A>B
B.A=10-4B
C.B=10-4A
D.A=B
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列电离方程式中正确的是( )
A.NaHCO3=Na++H++CO32-
B.Fe2(SO4)3=Fe3++SO42-
C.KClO3=K++Cl-+3O2-
D.NaHSO4=Na++H++SO42-
参考答案:D
本题解析:
本题难度:简单
4、选择题 在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是 ( )
A.溶液中2c(Na+)=c(SO42-)
B.a/2 mol>沉淀的物质的量>0
C.沉淀的物质的量=" a/2" mol
D.原溶液中c(H2SO4) =" a/2" mol/L
参考答案:B
本题解析:略
本题难度:一般
5、填空题 水的电离平衡曲线如图所示.
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从______增加到______.(填写具体数值)
(2)在25℃时将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持25℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为______.
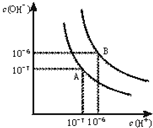
参考答案:(1)A点25℃时,c(H+)=c(OH-)=1×10-7m
本题解析:
本题难度:简单