微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
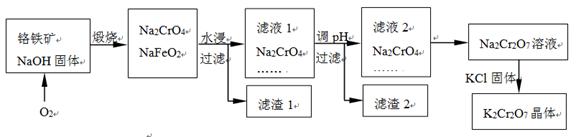
1、选择题 已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 (???)
A.海水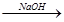 Mg(OH)2
Mg(OH)2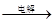 Mg
Mg
B.海水 MgCl2溶液
MgCl2溶液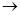 MgCl2熔融
MgCl2熔融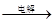 Mg
Mg
C.海水 Mg(OH)2
Mg(OH)2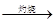 MgO
MgO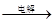 Mg
Mg
D.海水 Mg(OH)2
Mg(OH)2 MgCl2溶液
MgCl2溶液 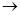 MgCl2熔融
MgCl2熔融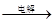 Mg
Mg
参考答案:D
本题解析:
试题分析:海水中的镁离子通过和石灰乳反应生成氢氧化镁白色沉淀,然后利用盐酸溶解氢氧化镁生成氯化镁。镁是活泼的金属,通过电解熔融的氯化镁即可以得到金属镁。石灰乳比氢氧化钠廉价易得,一般不用氢氧化钠,因此正确的答案选D。
点评:该题是基础性试题的考查,试题针对性强,紧扣教材教材。侧重对学生基础知识的巩固和训练,意在培养学生的应试能力,提高学生的学习效率。明确实验原理是答题的关键,注意从经济性的角度选择合适的试剂。
本题难度:一般
2、填空题 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。??② Cr2O72-+ H2O 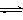 ?2CrO42- + 2H+
?2CrO42- + 2H+
 K2Cr2O7中Cr元素的化合价是?????。
K2Cr2O7中Cr元素的化合价是?????。
生成滤渣1中红褐色物质反应的化学方程式是?????????????????????????????????。
滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式)????????????????????。
利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是??????????????????????????????????????????????????????????。
由滤液2转化为Na2Cr2O7溶液应采取的措施是???????????????????????????????。
向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、?????、过滤、洗涤、干燥。
煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是????????????????????????。
参考答案:+6 (1分) ;NaFeO2+2H2O→Fe(OH)3↓+
本题解析:
试题分析:(1)根据化合物化合价的代数和为0可知,K2Cr2O7中Cr元素的化合价是+(2×7-1×2)÷2=+6价。
(2)由于NaFeO2遇水强烈水解,则生成滤渣1中红褐色物质反应的化学方程式是NaFeO2+2H2O→Fe(OH)3↓+NaOH。由于矿石中还含有氧化铝,且氢氧化钠是过量的,则滤液1的成分除Na2CrO4、Na2SiO3外,还含有NaOH、NaAlO2。
(3)由于滤液中含有偏铝酸钠,则可以制备氧化铝,电解熔融的氧化铝可以制备金属铝,反应的化学方程式是2Al2O3(熔
本题难度:一般
3、选择题 下列从海水中提取镁的工艺流程中,你认为最合理的是( ????)
A.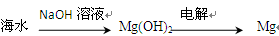
B.
C.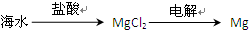
D.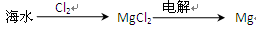
参考答案:B
本题解析:
试题分析:A项中Mg(OH)2不能直接电解,应该再加入盐酸使其转为MgCl2再进行电解,故A错误,B正确。海水中直接加入盐酸或Cl2,得不到纯净的MgCl2,电解后产物还有Na,故C、D不正确。
点评:本题主要考查从海水中提取镁的工艺流程,难度不大,解题的关键是先将Mg转为Mg(OH)2,再转为MgCl2,最后再电解。
本题难度:简单
4、选择题 随着社会的发展,目前复合材料的重要应用领域是
[???? ]
A.高分子分离膜
B.人类的人工器官
C.宇航工业
D.新型药物
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列无机非金属材料中,属于硅酸盐材料的是[???? ]
①光导纤维②氮化硅陶瓷③人造刚玉④水泥⑤玻璃
A.②④
B.④⑤
C.①②③
D.①②⑤
参考答案:B
本题解析:
本题难度:简单