微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质加入水中,能使水的电离度增大,溶液的pH值减小的是
A.HCl
B.Al2(SO4)3
C.Na2CO3
D.NH3·H2O
参考答案:B
本题解析:
试题分析:A、加热氯化氢,则溶液的氢离子浓度增大,所以会抑制水的电离,水的电离程度减小,错误;B、铝离子与水电离产生的氢氧根离子结合为氢氧化铝,使水电离产生的氢氧根离子浓度减小,所以会促进水的电离平衡正向移动,水的电离程度增大,氢离子浓度增大,溶液的pH减小,正确;C、碳酸根离子与水电离产生的氢离子结合为碳酸氢根离子,使水电离产生的氢离子浓度减小,水的电离平衡正向移动,但氢氧根离子浓度增大,溶液的pH增大,错误;D、一水合氨是弱碱,加入水中,会抑制水的电离,错误,答案选B。
考点:考查条件对水电离的影响
本题难度:一般
2、填空题 常温下有0. 1 mol/L的以下几种溶液,①H2SO4溶液②NaHSO4溶液③CH3COOH溶液④HCl溶液⑤HCN溶液⑥NH3·H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
①H2SO4溶液HSO4-
| ②NaHSO4溶液HSO4-
| ③CH3COOH
| ④HCl溶液
|
10%
| 29%
| 1.33%
| 100%
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是(填序号,下同) _
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温
同压下)由大到小的顺序是_ _
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH应选用_ 作指示剂,若终点时溶液pH = a,则由水电离的。c(H+)为_ 。
(4)在25℃时,将b mol·L-1的KCN溶液与0. O1 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH = 7,则KCN溶液的物质的量浓度b_ 0.01 mol·L-1填“>”、“<”或“=”);用含b的代数式表示HCN的电离常数Ka=
参考答案:(1)③>②>④>①⑵③>②>
本题解析:
试题分析:(1)由于pH相同的几种溶液,即氢离子浓度相同,弱酸是难电离的,故③CH3COOH的浓度是最大,①H2SO4溶液HSO4-中可以看作是比一元强酸稍大的酸,故浓度最小。其物质的量浓度由大到小的顺序是③>②>④>①。 (2)常温下,将足量的锌粉说明酸完全反应了,这与酸最终提供的氢离子量有关,故顺序为③>②>①>④。 (3)由于终点时生成强碱弱酸盐呈碱性,因此选择在碱性范围内变色的指示剂,应选用酚酞作指示剂,若终点时溶液pH = a,此时OH-全是水电离产生,则由水电离的氢离子和氢氧根相等。c(H+)=10-(14-a)mol/L。(4)KCN+HCl
本题难度:困难
3、填空题 下列物质?①Cu?②液态SO2??③纯醋酸??④NaHCO3?⑤Ba(OH)2溶液
I.属于非电解质的是______;(填序号)
Ⅱ.(1)NaHCO3是一种______(填“强”或“弱”)电解质;
(2)写出HCO3-水解的离子方程式:______;
(3)常温下,0.1mol-L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH?-五种微粒的浓度由大到小的顺序为:______.
Ⅲ.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
(1)该Ba(OH)2溶液的物质的量浓度为______;
(2)溶液中由水电离出c(OH?-)=______;
(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=______.
Ⅳ.醋酸是一种弱电解质.?某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.则图______(填“I”或“Ⅱ”)为醋酸稀释的图象.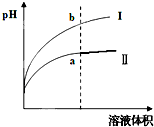
参考答案:Ⅰ、①Cu是金属单质能导电,但单质即不是电解质也不是非电解质
本题解析:
本题难度:一般
4、选择题 下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的H2SO4溶液中:c(H+)=10-3mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-)
C.在Na2CO3溶液中,2c(Na+)= c(CO32-)+ c(HCO3-) + c(H2CO3)
D.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
参考答案:A
本题解析:
试题分析:A.H2SO4是强酸,完全电离,若H2SO4溶液pH=3,则c(H+)=10-3mol/L,正确;B.根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于醋酸和醋酸钠的混合溶液呈中性,所以c(H+)=c(OH-),故c(Na+)=c(CH3COO-),错误;C.在Na2CO3溶液中,根据物料守恒可得c(Na+)="2" c(CO32-)+ 2c(HCO3-) + 2c(H2CO3),错误;D.氯化铵是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,破坏了水的电离平衡,最终当溶液达到电离平衡时,c(H+)>c(OH-);根据物料守恒可得c(Cl-)=c(NH4+)+c(NH3·H2O),所以在氯化铵溶液中,:c(Cl-)>c(NH4+)>c(H+)>c(OH-),错误。
考点:考查溶液中离子浓度的大小比较的知识。
本题难度:一般
5、选择题 某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是
①有晶体析出 ②c[Ca(OH)2]增大 ③pH不变
④c(H+)·c(OH)-的积不变⑤c(H+)一定增大
A.①
B.①⑤
C.①②④
D.①③
参考答案:B
本题解析:氧化钙能和水反应生成氢氧化钙,同时放热。由于氢氧化钙是饱和溶液,且氢氧化钙的溶解度随温度的升高而降低,所以溶液中会析出晶体。溶解度降低,浓度减小,因此碱性降低,所以氢离子浓度增大答案选B。
本题难度:一般
|