微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铂电极电解下列物质的水溶液,工作一段时间后溶液pH变小的是[???? ]
A.稀硫酸
B.Na2SO4
C.AgNO3
D.KI
参考答案:AC
本题解析:
本题难度:一般
2、填空题 (12分)如图装置闭合电键时,电流计A的指针将发生偏转。试回答下列问题。
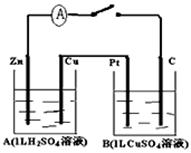
(1)A池是____________;Zn的电极名称是____________;B池是____________;
Pt的电极名称是____________(填电解池、原电池、阴、阳、正、负极等)
(2)写出下列有关反应:C极上电极反应:_________________
(3)B池中的总反应的化学方程式为________________________
参考答案:(1)原电池、负极、电解池、阳极;
Cu2++2e-=
本题解析:试题分析:(1)A池中存在自发进行的氧化还原反应,所以A池为原电池,Zn比Cu活泼为负极,Cu极为正极,B池为电解池,其中Pt接A中Cu极所以为阳极,C为阴极;因C为阴极, Cu2+放电,电极反应方程式为:Cu2++2e-=Cu;B池为电解池,阳极(Pt极)水中OH-放电,电极反应方程式为:2H2O-4e-=4H++O2↑所以B池总反应为:2H2O+2CuSO4 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
考点:了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:将原电池和电解池结合在一起,综合考查电极的判断、电极反应方程式的书写等。注重考查学生对知识的迁移能力、灵活应用能力、运用化学用语的能力,解答该类试题时电池种类的判断是关键,原电池一般是两种不同的金属电极或一种金属电极一个碳棒做电极;而电解池则一般都是两个惰性电极。
本题难度:一般
3、选择题 下列叙述正确的是
A.氢氧燃料电池中O2通入负极
B.铅蓄电池在放电时,其负极的电极反应为:Pb-2e=Pb2+
C.碱性锌锰电池在工作时,电解质中的OH-移向正极
D.在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
参考答案:D
本题解析:
试题分析:A.氢氧燃料电池中O2通入正极,错误;B.铅蓄电池在放电时,其负极的电极反应为:Pb-2e+SO42-=PbSO4↓,错误;C碱性锌锰电池在工作时,电解质中的OH-移向正电荷较多的负极,错误;D.在海轮外壳镶嵌锌块,由于金属活动性Zn>Fe,所以首先被腐蚀的是Zn,因此轮船就得到你了保护,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法,正确。
考点:考查原电池、电解池的反应原理及应用的知识。
本题难度:一般
4、选择题 如图,用有阳离子交换膜(只允许阳离子通过)的立式隔膜电解槽电解食盐水时,下列叙述错误的是

A.精制饱和氯化钠溶液从阳极区补充
B.产品烧碱溶液从阴极区流出
C.产品烧碱比未用离子交换膜时更纯
D.每转移NA个电子理论上可生成0.5mol 烧碱
参考答案:D
本题解析:
试题分析::A.电解食盐水时,阳极发生氧化反应,消耗NaCl,则应在阳极补充NaCl,故A正确; B.阴极生成OH-,且Na+向阴极移动,则产品烧碱溶液从阴极区流出,故B正确; C.未用离子交换膜时,阴极区混有NaCl,产品不纯,而用离子交换膜时,只有Na+向阴极移动,产品较为纯净,故C正确; D.电解方程式为2NaCl+2H2O=2NaOH+Cl2↑+H2↑,每转移NA个电子理论上可生成1mol烧碱,故D错误.故选D.
本题难度:一般
5、填空题 某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+ 、Mg2+)作系列探究,装置如图所示:

(1)电解时,甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因________________________________________________________________________。
(2)一段时间后,你认为C中溶液可能出现的现象是________________________,请用离子方程式表示原因______________________________________。
(3)实验结束后,乙同学将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加入到稀盐酸中却没有任何现象。请用化学方程式和简要的文字解释原因:________________________________________________________________________________________________________________________________________________。
(4)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去。他们对溶液红色褪去的主要原因提出了如下假设,请你完成假设二。
假设一:B中逸出的气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:___________________________________________________。
(5)请你设计实验验证上述假设一,写出实验步骤及结论:________________________________________________________________________________________________________________________________________________________。
参考答案:(1)2H++2e-=H2↑,Mg2++2OH-=Mg(OH
本题解析:电解饱和食盐水产生的气体为氢气和氯气,氯气具有强氧化性,而氢气在加热条件下具有较强还原性,根据装置图可知a、b分别为阴极和阳极,a极产生的氢气将氧化银还原为单质银,而b极产生的氯气可氧化硫化钠。
过量的氯气通入含酚酞的NaOH溶液中,溶液褪色的原因可能为中和,也可能是氯气与水反应生成的次氯酸的强氧化性所致。
本题难度:一般