微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 海水综合利用的工艺流程图如下:
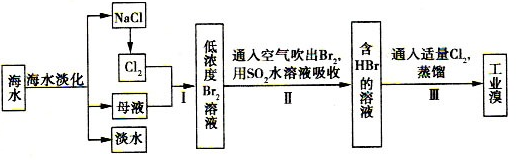
(l)电解NaCl溶液,在电解槽中可直接得到的产品有H2????????????、??????????或H2、???????????????。
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是?????????????。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为????????????,反应可知,除环境保护外,在工业生产中应解决的主要问题是?????????????????????????。
(4)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是??????????????????????,目的是???????????????;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由:????????????????????。
2、实验题 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3TiOSO4],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下:

请回答:
(1)步骤①中分离操作的名称是______;步骤⑥必须控制一定的真空度,原因是_________;
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2?xH2O)的化学方程式为__________;步骤④的离子方程式为_____________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因_______。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:_____Fe2++_____MnO4-+_____H+=_____Fe3++_____Mn2++_____
取步骤②所得晶体样品ag,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1KMnO4溶液20.00mL,则所得晶体中FeSO4?7H2O的质量分数为(以含a的式子表示)_____________________。
3、选择题 300?mL?0.1?mol/L的AlCl3溶液与200?mL?0.3?mol/L的NaCl溶液中c(Cl-)之比为
A.1:1
B.1:2
C.1:3
D.3:2
4、填空题 下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
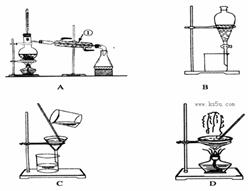
(1)从氯化钾溶液中得到氯化钾固体,选择装置???????(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置????????。
(2)从碘水中分离出I2,选择装置????????,该分离方法的名称为?????????????。
(3)装置A中①的名称是???????,进水的方向是从?????口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是????????????????????????????????????????。
5、选择题 从海带中提取碘的实验过程中,下列正确的操作是(??)