微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 海水综合利用的工艺流程图如下:
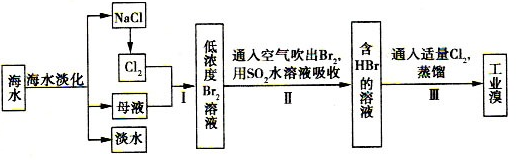
(l)电解NaCl溶液,在电解槽中可直接得到的产品有H2????????????、??????????或H2、???????????????。
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是?????????????。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为????????????,反应可知,除环境保护外,在工业生产中应解决的主要问题是?????????????????????????。
(4)分离出粗盐后的海水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从海水中提取镁的步骤为:
a.将海边大量存在的贝壳锻烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加人海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加人盐酸得到MgCl2溶液,再经蒸发结品得到MgCl2· 6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是??????????????????????,目的是???????????????;
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化生产步骤,体现简约性原则:你是否同意该同学的想法并说明理由:????????????????????。
参考答案:(1)Cl2? NaOH? NaClO????(2)富集溴元
本题解析:
试题分析:(1)电解NaCl溶液,在电解槽中可直接得到的产品有H2、Cl2、NaOH,若产物充分混合则Cl2与NaOH反应生成NaClO;(2)步骤I中已获得Br2是低浓度的,需要进一步富集达到工业生产的目的;)(3)反应产生强酸,具有腐蚀作用;(4)将MgCl2·6H2O在加热时会发生水解,故应在HCl气氛中加热,抑制MgCl2水解;因为MgO的熔点很高,熔融时会耗费大量的能量而增加成本,所以采用电解MgCl2。
本题难度:一般
2、实验题 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3TiOSO4],生产硫酸亚铁和补血剂乳酸亚铁。其生产步骤如下:

请回答:
(1)步骤①中分离操作的名称是______;步骤⑥必须控制一定的真空度,原因是_________;
(2)废液中的TiOSO4在步骤①能水解生成滤渣(主要成分为TiO2?xH2O)的化学方程式为__________;步骤④的离子方程式为_____________________。
(3)用平衡移动原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因_______。
(4)配平酸性高锰酸钾溶液与硫酸亚铁溶液反应的离子方程式:_____Fe2++_____MnO4-+_____H+=_____Fe3++_____Mn2++_____
取步骤②所得晶体样品ag,溶于稀硫酸配成100.00 mL溶液,取出20. 00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol·L-1KMnO4溶液20.00mL,则所得晶体中FeSO4?7H2O的质量分数为(以含a的式子表示)_____________________。
参考答案:
 本题解析:
本题解析:
该题是目的是生成乳酸亚铁和硫酸亚铁.
(1)步骤①中得到滤渣和硫酸亚铁溶液,其操作是过滤。步骤⑥必须控制一定的真空度,其主要原因是,有利于水分的蒸发,以,防止Fe2+被氧化。
(2)由于是水解,必然水是反应物,另外已知了产物,TiO2?xH2O,根据守恒方知另一产物是硫酸。这样就可以写水解方程式TiOSO4+(x+1)H2O=TiO2?xH2O+H2SO4。
(3))FeCO3存在着溶解平衡,这样乳酸电离出的H+就会影响平衡向正方向移动;
(4)由化合价升降守恒,就可把方程式配平。由方程式找出Fe2+与MnO4-的计算计量数关系,方可进行计算:
W(FeSO4?7H2O=(0.10000mol/L×0.02L×5×5×278g/mol)÷ag=13.9/a
本题难度:一般
3、选择题 300?mL?0.1?mol/L的AlCl3溶液与200?mL?0.3?mol/L的NaCl溶液中c(Cl-)之比为
A.1:1
B.1:2
C.1:3
D.3:2
参考答案:A
本题解析:根据氯化铝与氯化钠的化学式可知,溶液中氯离子浓度分别是0.1mol/L×3和0.3mol/L×1,所以两份溶液中氯离子的浓度之比是1︰1的,答案选A。
本题难度:简单
4、填空题 下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
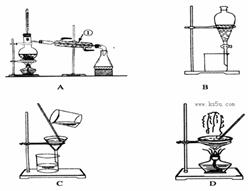
(1)从氯化钾溶液中得到氯化钾固体,选择装置???????(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置????????。
(2)从碘水中分离出I2,选择装置????????,该分离方法的名称为?????????????。
(3)装置A中①的名称是???????,进水的方向是从?????口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作是????????????????????????????????????????。
参考答案:(1)D?????????? A
(2)B?????
本题解析:
试题分析:(1)蒸发可以实现易溶于水的固体和水的分离,从氯化钾溶液中得到氯化钾固体可用蒸发,因蒸馏可以实现水中难挥发性杂质和水的分离,则除去自来水中的Cl─等杂质,可用蒸馏;(2)碘微溶于水,碘易溶于苯、四氯化碳等有机溶剂,且苯、四氯化碳与水互不相溶,可用萃取法分离;(3)装置A中①的名称是冷凝管,使用时下口进水上口出水;装置B在分液时为使液体顺利下滴,应进行的具体操作是将分液漏斗上部的玻璃塞打开;
本题难度:一般
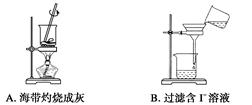
5、选择题 从海带中提取碘的实验过程中,下列正确的操作是(??)

参考答案:D
本题解析:A项,应选用坩埚,错误;B项,应用玻璃棒引流且漏斗下端要紧贴烧杯内壁,错误;C项,碘的苯溶液应从上口倒出,错误。
本题难度:一般