微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)(1)98%的密度为 1. 84 g/cm3的浓硫酸,其物质的量浓度为??????????????。若某溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,溶质的摩尔质量为M g/mol,则该溶液的中溶质的质量分数为????????????????????。
(2)483g Na2SO4·10H2O中所含的Na+的物质的量是???????,所含H2O分子的数目是??????????????,若将其溶于水配成2L溶液,SO42-的物质的量浓度为??????????????。
参考答案:(1)18.4 mol/L;CM/1000ρ? (2) 3m
本题解析:(1)根据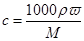 可知,硫酸的浓度是
可知,硫酸的浓度是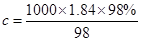 =18.4 mol/L;根据
=18.4 mol/L;根据 本题难度:一般
本题难度:一般
2、填空题 填写关于物质的量计算的四个恒等式:n=__________=__________=__________=__________。
参考答案:n=N/NA=m/M=V/Vm=CBV
本题解析:
本题难度:一般
3、选择题 若用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA
C.常温常压下,20 g D2O含有的原子总数为3NA
D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
参考答案:A
本题解析:
试题分析:A、BrCl中Br与Cl元素的化合价分别是+1价和-1价,与H2O完全反应生成氯化氢和次溴酸,元素的化合价均没有变化,不是氧化还原反应,A不正确;B、锌与硫酸反应不论是生成二氧化硫还是氢气,每产生1mol气体,均转移2mol电子,混合气是22.4L÷22.4L/mol=1mol,因此锌失去电子数为2NA,B正确;C、常温常压下,20 g D2O的物质的量是20g÷(1×2+18)g/mol=1mol,含有的原子总数为3NA,C正确;D、.标准状况下,44.8 L NO与22.4 L O2
本题难度:一般
4、实验题 实验室用NaCl晶体配制500mL 0.1mol/L的NaCl溶液:
(1)配制该溶液需称取NaCl晶体___________g,应选用___________mL的容量瓶;
(2)配制时,正确的操作顺序是(用字母表示)___________;
A. 用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B. 将称量好的NaCl晶体倒入烧杯中,加入约30mL水,用玻璃棒搅拌,使其混合均匀
C. 将烧杯中的溶液沿玻璃棒注入选好的容量瓶中
D. 将容量瓶盖紧、振荡、摇匀,静置后装入试剂瓶
E. 改用胶头滴管缓慢加水,使溶液凹面恰好与刻度相切
F. 继续往容量瓶内小心加水,直到液面接近刻度2-3cm处
(3)下列实验操作会使所配制的溶液物质的量浓度偏低的是(填序号)___________。
①称量时,将砝码放在带有游码的托盘天平的左盘上
②溶解搅拌或向容量瓶中转移时,有部分液体溅出
③未将洗涤液转移到容量瓶中
④定容时俯视刻度线
⑤加水定容时,超过刻度线
⑥配好的溶液,从容量瓶转移到干燥洁净的试剂瓶中,有少量溶液溅出
⑦定容时,盖好瓶塞摇匀后发现液面略低于刻度,再加蒸馏水至刻度线
参考答案:(1)2.9g ;500mL
(2)B C A F
本题解析:
本题难度:一般
5、实验题 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为I A,通电时间为t min后,精确测得电极上析出铜的质量为m g。

试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接 ,C接 , 接F。
(2)写出B电极上发生的电极反应式: ;
G试管中淀粉KI溶液变化的现象为 ,
相应的离子方程式是 。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是 。(选填下列操作步骤的编号)
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极 ④低温烘干电极后称量
⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA= 。
参考答案:(1)D A
本题解析:
试题分析:
(1)由于U形管右侧有一处理气体的支管,所以可推知B电极为有Cl2生成的一极,即为阳极。显然F应与B连接,A为阴极,结合电流表接入线路的物理知识,A应接C,D接E。
(2)电解CuCl2,阴、阳两极的电极反应式为:阴极:Cu2++2e=Cu;阳极:2Cl--2e=Cl2↑
生成的Cl2通入G试管,与KI反应,置换出I2,I2可使淀粉溶液呈现蓝色。
(3)为了精确测定电极上析出的铜的质量,显然应采用测定电解前后A电极增重的方法。具体操作为:在电解前先称量A电极的质量,电解后先用蒸馏水清洗电极(洗去附着的离子),然后需将电极烘干(除去附着的水),为防止Cu被氧化,应在低温下烘干后再进行称量,为防止误差,还应再低温烘干称量,直至恒重。
(4)电解时,当电流强度为IA,通电时间为tmin钟内,通过的总电量为:Q=ItC,通过的电子的物质的量为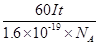 mol。由题意知阴极析出mgCu,转移的电子的物质的量为
mol。由题意知阴极析出mgCu,转移的电子的物质的量为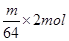 。由上述分析可建立等式:
。由上述分析可建立等式: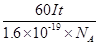
 , 由此式即可得NA的表达式:
, 由此式即可得NA的表达式: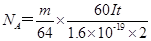 。
。
考点:考查电解池、理化仪器的使用、阿伏伽德罗常数的计算
点评:本题将物理中电路连接与化学中仪器连接相结合,将电学知识与电解原理相结合,并设置一个利用电解方法来验证阿佛加德罗常数的全新情境,具有一定的深度和灵活性。解题时应将理化相关知识有机融合,方能解决相关问题。
本题难度:困难