微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e- ==4H2O?? O2+2H2O+4e-==4OH-下列说法错误的是
A.氢气通入正极,氧气通入负极
B.燃料电池的能量转化率不能达到100%
C.供电时的总反应为:2H2+O2 ="===" 2H2O
D.产物为无污染的水,属于环境友好电池
参考答案:A
本题解析:原电池中负极失去电子,被氧化,正极得到电子,被还原。所以在氢氧燃料电池中氢气在负极通入,氧气在正极通入,因此选项A是错误的,其余都是正确的,答案选A。
本题难度:一般
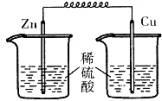
2、选择题 在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是[???? ]
A.正极附近的SO42-浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列各装置中,能构成原电池的是( )

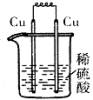

A B C D
参考答案:A
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连且插入电解质溶液中,所以A正确。B和C中电极相同,D中没有形成完整的闭合回路。答案是A。
本题难度:一般
4、填空题 利用Cu+?2FeCl3=CuCl2+ 2FeCl2反应,设计一个原电池,写出电极反应式。
_______________________________________________
参考答案:![]() 本题解析:
本题解析:
本题难度:一般
5、填空题 北京时间2013年12月2日凌晨1时30分,我国的“嫦娥三号”月球探测器在西昌卫星发射中心发射升空,发射“嫦娥三号”月球探测器的火箭推进器中装有还原剂肼(N2H4)和氧化剂N2O4,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。
(1)写出肼和N2O4反应的热化学方程式: ;
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g气态肼与足量N2O4气体反应生成氮气和液态水时,放出的热量是 ;
(3)肼除应用于火箭燃料外,还可作为燃料电池的燃料,由肼和空气构成的碱性燃料电池的负极反应式为: ,正极反应式为: ;
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼,写出反应的离子方程式: 。
参考答案:(1)2N2H4(g)+N2O4(g) = 3N2(g)+4
本题解析:
试题分析:(1)已知0.4 mol气态肼和足量N2O4气体反应生成氮气和水蒸气时放出219.3 kJ的热量。则2mol液态肼放出的热量为219.3 kJ×5=1096.5 kJ
所以反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(g) ΔH=-1096.5kJ·mol-1
(2)已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1
所以有反应的热化学方程式为:2N2H4(g)+N2O4(g) = 3N2(g)+4H2O(l) ΔH=-1272.5kJ·mol-1
16 g气态肼的物质的量="16g/32g/mol=0.5mol," 放出的热量Q=1272.5 kJ /4="318.1" kJ
(3)由肼和空气构成的碱性燃料电池的负极反应式为:N2H4-4e-+4OH- = N2+4H2O 正极反应式为:O2+4e-+2H2O = 4OH-
(4)向次氯酸钠溶液中通入一定物质的量的氨气可生成肼, 次氯酸钠是氧化剂,被还原为氯化钠,氨气做还原剂,被氧化为肼。2NH3+ClO-= N2H4+Cl-+H2O
考点:热化学方程式的书写,电极反应式的书写。
本题难度:一般