……
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②恒温固定体积的容器中,下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内各物质的浓度之比为化学计量数比
B.混合气体密度保持不变
C.容器内压强保持不变
D.混合气体相对分子质量保持不变
(3)某化学小组同学模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。
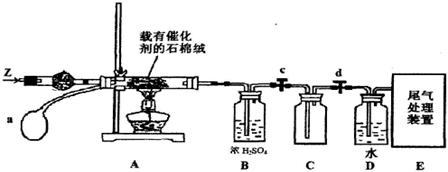
①A中发生反应的化学方程式是 。
②B中浓H2SO4的作用是 。
(4)写出D装置中反应的化学方程式 。
(5)a中通入空气的作用 。
参考答案:(1)N2(g)+3H2 本题解析: 本题解析:
试题分析:(1)5个原子核的10电子的微粒一般为CH4、NH4+NH4+,W为无色液体,10电子的无色液体为H2O,所以猜想该反应为NH4+与OH-制取NH3的反应,X为NH4+,Y为OH-,Z为NH3。工业制取氨气的化学反应为N2+3H2 2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2 2NH3,每制取1molNH3要放出46.2kJ的热量,所以该反应的热化学方程式为N2(g)+3H2 2NH3(g) ΔH=—92.4KJ/mol 2NH3(g) ΔH=—92.4KJ/mol
(2)①制取氨气的反应为放热反应,升高温度有利于平衡逆向移动,平衡常数减小,所以K1>K2
②A、达平衡时容器内各物质的浓度之比不一定为化学计量数比,错误;B、恒容的容器中,气体的密度始终不变,错误;C、随着反应的进行,气体的压强逐渐减小,达平衡时不再变化,正确;D、随着反应的进行,气体的物质的量逐渐减小,气体的相对分子质量逐渐增大,达平衡时不再变化,正确,答案选CD。
(3)①A中发生反应是氨气的催化氧化,其化学方程式是4NH+5O2 4NO+6H2O 4NO+6H2O
②浓H2SO4具有吸水性,也可以和氨气反应,所以B中浓H2SO4的作用是吸收水和多余的氨气
(4)由于空气的不断鼓入,二氧化氮与水、氧气完全反应生成硝酸,化学方程式为4NO2+O2+2H2O=4HNO3或3 NO2+H2O=2HNO3+NO
(5)a中通入空气的作用就是不断氧化NH3和NO
考点:考查10电子微粒的推断,氨气的合成,硝酸的制取,化学平衡常数的比较,平衡状态的判断,化学方程式的书写
本题难度:困难
2、选择题 下列说法中正确的是
A.在气体单质分子中,一定含有σ键,可能含有π键
B.烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键
C.等电子体结构相似,化学性质相同
D.共价键的方向性决定了原子在形成分子时相互结合的数量关系
参考答案:B
本题解析:稀有气体分子中没有化学键,A不正确。C不正确,等电子体的化学性质只能是相似。共价键的饱和性决定了原子在形成分子时相互结合的数量关系,共价键的方向性一般决定键角大小,D不正确。所以正确的答案是B。
本题难度:一般
3、填空题 (18分)(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_____________填序号),写出反应⑥的化学方程式__ ____。
(3)在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是 ,②只有极性共价键的共价化合物是 ,
③只含有非极性共价键的是 ,④既有离子键又有非极性键的化合物是 。
参考答案:(1)6 ⅣA
本题解析:
试题分析:(1)由于各个周期所包含的元素种类数分别是2、8、8、18、18、32、32,所以82号元素X应是第六周期第ⅣA的元素,它的最高正价氧化物的化学式为XO2或PbO2。(2)在已知的反应中属于放热反应的是③ ④ ⑤;反应⑥的化学方程式是Ba(OH) 2·8H2O+2NH4Cl=BaCl2 + 2NH3↑+10H2O;(3)①只由非金属组成的离子化合物是NH4Cl;②只有极性共价键的共价化合物是CO2;③只含有非极性共价键的是I2;④既有离子键又有非极性键的化合物是Na2O2。
考点:考查化学反应按照反应热的分类、物质的作用力与物质种类的关系、化学方程式的书写的知识。
本题难度:一般
4、选择题 与氖(Ne)原子电子排布相同的两种离子组成的化合物是(?)
A.Na2S
B.KCl
C.MgCl2
D.NaF
参考答案:D
本题解析:Ne核外电子是10个,所以选项D是正确的,硫离子、氯离子和钾离子都是18电子的,答案选D。
本题难度:一般
5、选择题 下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.在稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H= -57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
C.在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H= -285.8kJ/mol
D.由C(s,石墨)=C(s,金刚石)△H= +1.90kJ/mol可知,石墨比金刚石稳定
参考答案:BD
本题解析:
试题分析:A、气态硫的能量高于固态硫的能量,所以等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多,A错误;B、在稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H= -57.3kJ/mol,浓硫酸溶于水放热,所以若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ,B正确;C、在101kPa时,2g的氢气完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:H2(g)+1/2O2(g)=H2O(l) △H= -285.8kJ/mol,C错误;D、由C(s,石墨)=C(s,金刚石) △H= +1.90kJ/mol可知,石墨能量低于金刚石能量,所以石墨比金刚石稳定,D正确,答案选BD。
考点:考查反应热、中和热判断以及热化学方程式书写
本题难度:一般
|