微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列操作能达到目的是( )
A.石油分馏时把温度计插入受热的液体中
B.用酸性高锰酸钾溶液除去乙烯中含有的SO2
C.用乙醇和98%的硫酸共热到170℃制乙烯
D.将苯和溴水混合后加入铁粉制取溴苯
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列从混合物中分离出其中的一种成分,所采取的分离方法正确的是 [???? ]
A.由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来
B.水的沸点为100℃,酒精的沸点为78.5℃,所以可用加热蒸馏的方法使含水的酒精变为无水酒精
C.四氯化碳和水混合后,可用分液的方法来分离
D.NaCl溶解度随温度下降而减小,所以用冷却法从热的含少量KNO3的NaCl溶液中分离得到纯净的NaCl
参考答案:C
本题解析:
本题难度:简单
3、实验题 某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成一种Cu(OH)2沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的离子反应方程式为:???? _????;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为 ①过滤②洗涤③干燥。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
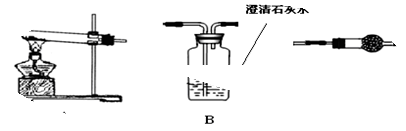
(1)各装置连接顺序为?????? ???????
??????? ???????。
???????。
(2)装置C中装有的试剂名称是????????????????????????????。
(3)按你的装置连接顺序,甲的猜想是正确的,则可通过________________________现象来说明甲的猜想是正确的。
Ⅲ.若CuCO3和Cu(OH)2两者都有,丙同学通过装置Ⅰ进行定量分析来测定其组成。
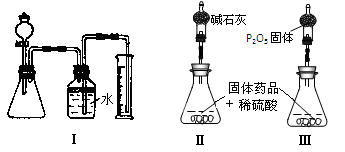
(1)实验有关操作为:①往锥形瓶中放入适量的样品:②从分液漏斗往锥形瓶中加入过量的稀硫酸;③检验装置的气密性;④测定收集到水的体积。
正确的操作顺序为____________________。
(2)广口瓶中水的上面覆盖了一层植物油,若瓶中的液体没有装满(上方留有少量空间),实验测得CO2的体积将___________(填偏大、偏小或不变)。
(3)若实验中测得样品的质量为wg,气体的体积为aL(标况下),则样品中CuCO3的质量分数为___________(CuCO3的式量为124)。
(4)丁同学认为,丙同学的实验方法,可能因气体体积测量不准,导致误差较大。建议改用图中的Ⅱ、III装置进行实验。只需进行简单而又必要的数据测定,可比较准确地确定样品中CuCO3的质量分数,较合理的装置_______(填代号)。但是丁同学的装置仍然有缺陷,所测结果将偏高或偏低__________。理由是___________________________
参考答案:Ⅰ.Cu2++CO32-+H2O=Cu(OH)2+CO2
本题解析:
试题分析:
Ⅰ乙同学的认为:这两者相互促进水解反应,生成Cu(OH)2一种沉淀,即是碳酸钠和硫酸铜之间发生双水解反应,原理为:Na2CO3+CuSO4+H2O═Cu(OH)2↓+Na2SO4+CO2↑
Ⅱ.(1)利用加热装置验证生成的产物,利用A加热分解碳酸铜或氢氧化铜,利用C检验是否有水生成验证是否含有氢氧化铜;利用装置B中 石灰水变浑浊证明生成二氧化碳验证碳酸铜的存在,所以装置连接为A、C、B;
(2)无水硫酸铜可以检验水的产生和存在,放在干燥管中来检验,故答案为:无水硫酸铜;
(3)碳酸铜受热分解会产生氧化铜和二氧化碳,二氧化碳可以使澄清的石灰水变浑浊,
Ⅲ(1)应先进行装置气密性检验,然后依次加入固体药品、液体药品,最后进行气体排出水的测量,确定产生气体体积;
(2)广口瓶的液体没有装满,不会影响测定的结果
(3)产生的气体二氧化碳气体的体积为aL,n CO2="n" CuCO3=" a/22.4,m" CuCO3= a/22.4×124
则样品中CuCO3的质量分数为a/22.4×124/W
(4)较合理的装置是Ⅲ,因为用碱石灰吸收二氧化碳和水,无法求出CuCO3的质量。P2O5只吸收水蒸气。先求Cu(OH)2,再求得CuCO3的质量。
此题的答案是开放性的,只要合理就行;偏高 锥形瓶中水蒸气残留?或者偏低?盛有P2O5的干燥管吸收空气中的水蒸气,质量偏大,导致Cu(OH)2质量偏大,测得的CuCO3的质量分数偏低。
本题难度:一般
4、选择题 在一定体积的容器中加入1.5 mol氙气(Xe)和7.5 mol氟气(F2),于400℃和2633 kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还有4.5 mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是.
A.1∶2
B.1∶3
C.1∶4
D.1∶6
参考答案:C
本题解析:实际参加反应的Xe和F2的物质的量之比为:1.5∶(7.5-4.5)=1∶2,则生成物中Xe原子和F原子的物质的量之比为1∶4.
本题难度:困难
5、选择题 下列溶液中,溶质的物质的量浓度为1mol?L-1?的是
A.将40?g?NaOH溶于1?L?水所得的溶液
B.将5?mol?L-1的H2SO4溶液100ml稀释成500ml
C.NA个氯化氢分子溶于水配成1L溶液
D.c(K+)为1?mol?L-1的K2SO4溶液
参考答案:BC
本题解析:分析:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液浓度为1mol?L-1;
B.根据n=cv解题;
C.NA个氯化氢分子物质的量是1mol;
D.根据硫酸钾的化学式可知钾离子浓度为硫酸钾浓度的2倍.
解答:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液浓度为1mol?L-1,不是溶剂的体积为1L,故A错误;
B.根据n=cv=5?mol?L-1×0.1L=0.5mol,溶液的体积是0.5L,所以溶液浓度为1mol/L,故B正确;
C.NA个氯化氢分子物质的量是1mol,溶于水配成1L溶液浓度为1mol/L,故C正确;
D.钾离子浓度为硫酸钾浓度的2倍,含K+为1mol?L-1的K2SO4溶液浓度为0.5mol/L,故D错误.
故选BC.
点评:本题考查物质的量浓度的理解与计算,难度较小,注意物质的量浓度中体积指溶液体积,物质溶于水溶质变化的情况.
本题难度:一般