微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (2分)已知
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1="+532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
参考答案:方程式略 ΔH=+58.73KJ/m
本题解析:由所给热化学方程式可得到:
①Na2CO3(s)+10H2O(g)=Na2CO3·10H2O(s) ΔH1=—532.36 kJ·mol-1
②Na2CO3·H2O(s)+9H2O(g)=Na2CO3·10H2O(s) ΔH1=—473.63 kJ·mol-1
②-①可得:Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH=+58.73KJ/mol
本题难度:一般
2、填空题 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=
参考答案:
本题解析:
本题难度:一般
3、填空题 氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度?????(填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是???????????????????????。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是???????????????????????。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
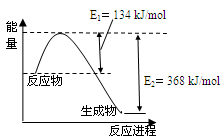
已知:N2(g)+O2(g)=2NO(g)??△H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g)?????△H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是???????。
N2(g)+2CO2(g)的△H是???????。
参考答案:(1)大于????(2)c(NO3-)>c(NH4+)>c(
本题解析:
试题分析: (1)酸、碱抑制水的电离、能水解的盐促进水的电离。
(2)0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合后c(Na+)=0.05mol/L、c(NO3-)=0.1mol/L,由2c(NH4+)>c(NO3-)得c(NH4+)>0.05mol/L。电荷守恒式为c(Na+)+c(NH4+)+c(H+)=c(NO3-)+c(OH-),由c(Na+)、c(NO3-)、c(NH4+)得c(OH-)>c(H+)。所以c(NO3-)>c(NH4+)>c(Na+
本题难度:一般
4、选择题 某无色酸性溶液中,可以大量存在的是
A.K+、Na+、CO32-、Cl-
B.K+、Na+、NO3-、HCO3-
C.Na+、K+、Cl-、SO42-
D.MnO4-、Na+、Cl-、SO42-
参考答案:C
本题解析:分析:无色酸性溶液含大量的H+,根据离子之间不能结合生成水、气体、沉淀、弱电解质等,则不能共存,并结合离子的颜色来解答.
解答:A.因H+、CO32-结合生成水和气体,则不能共存,故A错误;
B.因H+、HCO3-结合生成水和气体,则不能共存,故B错误;
C.该组离子之间不反应,且均为无色,故C正确;
D.该组离子之间不反应,能共存,但MnO4-为紫色,与无色溶液不符,故D错误;
故选C.
点评:本题考查离子的共存,侧重复分解反应发生的条件的考查,熟悉常见物质的状态、溶解性即可解答,题目难度不大.
本题难度:一般
5、选择题 下列说法正确的是 (?? )
A.HF比HCl稳定是由于HF分子间存在氢键所引起的
B.水在结冰时密度变小是由于水分子间存在氢键所引起的
C.CH4分子很稳定,是由于分子间氢键的存在而导致的
D.离子化合物肯定含有金属元素,故在微粒间不存在共价键
参考答案:B
本题解析:
试题分析:氢化物分子的稳定性和共价键有关系,与氢键无关。氢键不是化学键,一般影响的是物质的物理性质,A、C不正确;水分子间存在氢键,影响水的物理性质,B正确;离子化合物中不一定含有金属元素,例如氯化铵,微粒间存在共价键,D不正确,答案选B。
点评:该题主要是考查学生对氢键以及氢键对物质性质影响的熟悉了解程度,属于中等难度的试题。旨在巩固学生的基础,提高学生的应试能力和学习效率。
本题难度:一般