微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种(Cu
的相对原子质量按63.5计)。
(1)现采用氢气还原法,请回答下列问题:
已知xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式为xCuCO3·yCu(OH)2·zH2O+(x+y)H2 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O
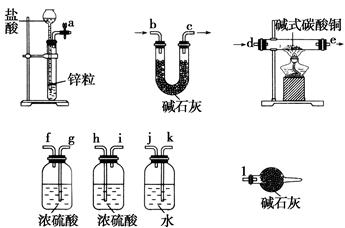
①实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l);
②称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为________g,化学式为________。
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由_________________________________________________________
参考答案:(1)①k j g(或h) f(或i) d e h(或g)
本题解析:(1)①由实验目的和实验装置知,该实验要测定生成的水、二氧化碳的量,而从a口出来的氢气中含有水蒸气和挥发出来的氯化氢,会对实验有干扰,所以应先用水吸收氯化氢,再用浓硫酸吸收水蒸气,再通入碱式碳酸铜中发生反应,而产生的两种气体应先用浓硫酸吸收水蒸气,再用U形管中的碱石灰吸收二氧化碳,同时要连接上装有碱石灰的球形干燥管,防止空气中的水蒸气和二氧化碳进入U形管而产生误差。②根据所给数据可计算出生成的铜、二氧化碳、水的物质的量分别为0.2 mol、1 mol、0.4 mol,所以可知(x+y)∶x∶(x+2y+z
本题难度:一般
2、选择题 标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1 Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是
A.所得沉淀为0.05 mol的BaSO4
B.混合气体中SO2的体积为0.448 L
C.a L混合气体的物质的量为0.04 mol
D.a的取值范围为0.672<a<0.896
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (6分)铁和铜作为常见金属,在生活中有着广泛的应用。
(1)硫酸铁在工业上可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)则下列说法正确的是???????(选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1mol电子时,46 g CuFeS2参加反应
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI + Hg = Cu2HgI4 + 2Cu,以上反应中的氧化剂为______; CuI可由Cu2+与I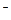 直接反应制得,请配平下列反应的离子方程式:???Cu2+ + ???I
直接反应制得,请配平下列反应的离子方程式:???Cu2+ + ???I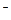 ?— ???CuI + ???I
?— ???CuI + ???I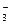
参考答案:(1)d????(2)CuI???????2 ??Cu2+
本题解析:略
本题难度:一般
4、选择题 部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:

下列说法正确的是(? )。
A.滤液A中的阳离子为Fe3+、Fe2+、H+
B.样品中Fe元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896
参考答案:B
本题解析:根据题意,3.2 g滤渣一定是铜,而铜与Fe3+不共存,则A项错误;最后的3.2 g固体为Fe2O3,其中Fe元素的质量为2.24 g,B正确;样品中Cu元素和O元素共5.76 g-2.24 g=3.52 g,则C项错误;因2.24 g Fe元素已部分氧化,且Fe还与Fe3+、Cu2+发生反应,故生成的氢气的体积应小于896 mL,D错误。
本题难度:一般
5、填空题 (15分) 现代社会,铁合金可说是金属材料王国的霸主,铁广泛存在于铁的氧化物及多种矿石中,如下表所示:
矿石名称
| 磁铁矿
| 黄铁矿
| 赤铁矿
| 黄铜矿
|
主要成分
| Fe3O4
| FeS2
| Fe2O3
| CuFeS2
????
请回答下列问题:
(1)在上表所列铁的化合物中,铁元素的质量分数含量最高的是????????。
(2)工业上生产硫酸常以硫铁矿为原料,在沸腾炉中加热使硫元素转化为二氧化硫,其反应的方程式为:4FeS2+11O2 2Fe2O3+8SO2,该反应中被氧化的元素是??????????,生成1molFe2O3转移电子的物质的量为???????mol。 2Fe2O3+8SO2,该反应中被氧化的元素是??????????,生成1molFe2O3转移电子的物质的量为???????mol。
(3)生产硫酸的工业尾气中含有大量的SO2,若直接排放到大气中造成环境污染的后
果是??????????,处理该尾气则可得到一种有价值的盐,请写出该盐的名称??????????。
(4)据统计,地球上每年由于腐蚀而消耗的铁约占铁的年产量的10%,铁发生腐蚀的主要原因是?????(填写下面选项的序号)。
a. 直接与氧气发生了化学腐蚀????
b. 通过原电池发生电化学腐蚀???
c.与酸雨发生反应而消耗?
若你选定选项a或c,请写出相应的化学方程式???????????????????????????????; 若
你选定选项b,请写出负极的电极反应式??????????????????????????。
参考答案:(1)磁铁矿(或Fe3O4)?(2)Fe、S (3分);??
本题解析:(1)四种铁的化合物中采用“改写化学式”的巧算方法易知Fe3O4中Fe的质量分数
最高;(2)在4FeS2+11O2 2Fe2O3+8SO2中,物质FeS2中Fe由+2价升到+3价;S由-1价升 2Fe2O3+8SO2中,物质FeS2中Fe由+2价升到+3价;S由-1价升
到+4价,两种元素均被氧化,氧化剂只有O2,该反应转移电子的物质的量为11mol×4,所以
生成1m
本题难度:一般
|