微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将氢气通入10g灼热的氧化铜中,过一段时间后得到8.4g固体,下列说法正确的是( )
A.有8.4g铜生成
B.有8g氧化铜参加反应
C.有1.6g水生成
D.有10g氧化铜被还原
参考答案:B
本题解析:根据题意,10g氧化铜不一定全部参加反应,所以得到的8.4g固体也不一定都是铜的质量。我们可以利用“固体-固体”差量法解决此题。反应前后固体的质量差(10-8.4=1.6g)=参加反应的氧化铜的质量-生成的铜的质量=CuO-Cu,即理论上每80份质量的CuO参加反应转化为64份质量的Cu,固体质量减少16份,据此可列比例求解。
H2+CuO-Cu+H2O △m(固体质量减少)
80 64 18 80-64=16
x y z 10-8.4=1.6g
可以求出![]()
本题难度:简单
2、填空题 CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
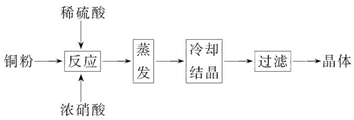
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:_____________、_____________。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是_____________,除去这种杂质的实验操作称为_____________。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。称取0.100 0 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.100 0 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用
0.100 0 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.100 0 g该试样中含CuSO4·5H2O_____________g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用_____________。
参考答案:(1)铜粉溶解,溶液呈蓝色??有红棕色气体产生
(2)
本题解析:(1)铜和浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+
2NO2↑+2H2O,其反应现象是铜逐渐溶解,溶液变蓝,产生红棕色气体。加入稀硫酸的目的是H+和Cu(NO3)2中的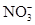 结合成HNO3,继续和铜反应,尽可能地降低溶液中
结合成HNO3,继续和铜反应,尽可能地降低溶液中 本题难度:一般
本题难度:一般
3、填空题 氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
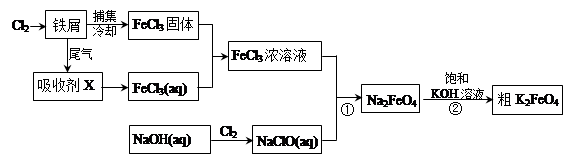
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________???????__________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为?????????????? ???。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示)???????????????????????。正确的检验方法是:取少量待测液,加入???????????????(写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因??????????????????????。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因??????????????????????。
(5)将粗K2FeO4产品经重结晶、过滤、??????????、?????????,即得较纯净的K2FeO4。
参考答案:(1)①Fe3++3H2O 本题解析:
本题解析:
试题分析:(1)①氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故;②工业上常用FeCl3溶液腐蚀铜印刷线路板。是Fe3+氧化了Cu的缘故,FeCl3较强的氧化性。
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2。为检验吸收剂是否已完全转化为FeCl3溶液,用酸性高锰酸钾溶液不能验证,因为Cl-能被酸性高锰酸钾氧化为Cl2。Fe2+与铁氰化钾溶液或深蓝色沉淀产生,可用此显色反应来验证是否存在Fe2+。
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3
本题难度:一般
4、选择题 人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”;在常温下,下列可以盛放在铁制容器中的物质是
A.浓H2SO4
B.稀HNO3
C.盐酸
D.CuSO4溶液
参考答案:A
本题解析:铁在常温下可与稀硝酸、盐酸、硫酸铜溶液反应,但在常温下与浓硫酸钝化,故A符合题意
本题难度:一般
5、选择题 向2mL 0.5mol/L的FeCl3溶液中加入3mL 3mol/L KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(???)
A.Fe3+不与I-发生反应
B.Fe3+与F-结合成不与I-反应的物质
C.F-使I-的还原性减弱
D.Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+
参考答案:B
本题解析:由题意可知,向FeCl3溶液中加入过量的KF溶液后,溶液褪色,说明Fe3+?已经与F-?生成了新物质,但不可能发生氧化还原反应,因为F-?的还原性极差,Fe3+?不可能氧化它;再者,向褪色后的溶液中继续加入KI溶液和CCl4振荡后静置,CCl4层不显色,说明Fe3+?与F-?结合生成的新物质不能氧化I-?,或者说不与I-?反应,故答案为B
本题难度:一般