微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)甲醇可作电池的原料,也会造成环境污染。请根据有关反应回答问题。
(1)以CH4和H2O为原料,通过下列反应可制备甲醇。
①CH4(g)+H2O(g)?CO(g)+3H2(g) △H =+206.0 kJ·mol-1
②CO(g)+2H2(g)?CH3OH (g) △H=-129.0 kJ·mol-1
则CH4(g)+H2O(g) ?CH3OH (g)+H2(g)的△H= kJ·mol-1。
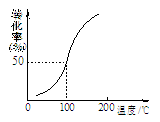
(2)将1.0 mol CH4(g)和2.0 mol H2O(g)通入容积为10 L的容器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。设100℃时达到平衡所需的时间为5 min,
则这时间段v(H2)= mol·L-1·min-1。
(3)在一定温度下,将一定量CO和H2充入密闭容器发生反应②。达到平衡后,若压缩容器体积至原来的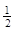 ,对平衡体系产生的影响是 (填序号)。
,对平衡体系产生的影响是 (填序号)。
①c ( H2 )减小 ②CH3OH 的物质的量增加 ③新平衡时,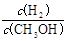 减小,
减小,
④正反应速率加快,逆反应速率减慢 ⑤平衡常数K增大
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,则:
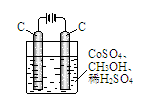
①Co2+在阳极的电极反应式为 ;
②请完成除去甲醇的离子方程式:Co3++CH3OH+ = Co2++CO2↑+6H+
参考答案:(1)(2分)+77.0 (2)0.0
本题解析:
试题分析:(1)根据盖斯定律,反应CH4(g)+H2O(g)?CH3OH (g)+H2(g)将①+②可得,则△H=(+206.0KJ/mol)+(-129.0KJ/mol)=-77KJ/mol;
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为10L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4(g)+H2O (g)="CO" (g)+3H2(g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平衡反应速率V(H2)=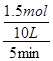 ="0.03" mol?L-1?min-1;
="0.03" mol?L-1?min-1;
(3)在一定条件下,将一定量的CO和氢气的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ/mol;平衡后将容器的容积压缩到原来的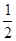 ,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
,其他条件不变,体积减小压强增大,反应速率增大,平衡正向进行。①体积减小,c(H2)增大,错误;②体积减小,压强增大,平衡正向移动,CH3OH的物质的量增加,正确;③体积减小,压强增大,平衡正向进行,重新平衡时c(H2)/c(CH3OH)减小,正确;④压强增大,正逆反应速率都加快,错误;⑤平衡常数K只随温度的变化而变化,错误;故选②③;(4)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:考查电化学基础、化学平衡的影响因素。
本题难度:困难
2、填空题 (17分)铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为 。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是 (用序号填写)。

(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)  H="-1118" kJ·mol-1
H="-1118" kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)  H="-1675.7" kJ·mol-1
H="-1675.7" kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为 。
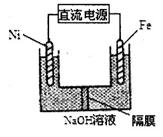
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式 。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是 。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是 。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]= 。

已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度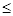 10-5 mol·L-1时,可认为沉淀完全)。
10-5 mol·L-1时,可认为沉淀完全)。
参考答案:(17分)(1)2Fe + O2 + 2H2O = 2Fe(
本题解析:
试题分析:(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为: 2Fe + O2 + 2H2O = 2Fe(OH)2;①Zn为负极,Fe为正极,Fe受到保护;②Fe与硫酸发生置换反应,被氧化变为Fe2+,比①腐蚀的快;③构成Fe-Cu原电池,Fe作负极,首先被腐蚀,腐蚀速率③>②;④形成电解池,Fe为阴极,被保护,只要存在外加电源,Fe就不会被腐蚀,所以腐蚀速率④<①;⑤构成电解池。由于Fe为阳极,被氧化,发生氧化反应,腐蚀速率比③快。所以铁腐蚀的速率由快到慢的顺序是⑤③②①④;
(2)②×4-①×3,整理可得:8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= ?3349.8 kJ·mol-1;(3)Na2FeO4具有强氧化性,其电解制法如图所示,则在阳极,Fe失去电子,被氧化,与溶液中的OH-结合反应,阳极的电极反应式是Fe + 8OH- -6e-= FeO42- + 4H2O;Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是Na2FeO4中的Fe化合价为+6价,具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+发生水解反应生成Fe(OH)3胶体,表面积大,吸附能力强,能吸附水中杂质,使之形成沉淀,从水中分离出去,从而使水得到净化。(4)工业上常用FeCl3溶液腐蚀印刷线路板,Fe3+将Cu单质氧化为Cu2+,Fe3+被还原变为Fe2+,根据电子守恒、电荷守恒及原子守恒,可得发生反应的离子方程式是2Fe3+ + Cu = 2Fe2+ +Cu2+;根据图像可知,在溶液的pH接近3而小于3时,Fe3+已经沉淀完全。所以在溶液的pH=5.6时,溶液中存在的金属阳离子为Cu2+、Fe2+;Fe(OH)2的溶度积Ksp[Fe(OH)2]=c(Fe2+)?c2(OH-)=10-5×(10-14÷10-8)21.0×10-17(mol·L-1)3。
考点:考查化学反应方程式的书写、金属腐蚀快慢比较、电解原理在物质制备的作用、水的消毒净化的原因分析、氧化还原反应在工业上的应用、沉淀溶解平衡原理的应用的知识。
本题难度:困难
3、选择题 用惰性电极电解 和
和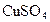 的混合液,且已知
的混合液,且已知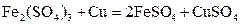 ,下列说法正确的是
,下列说法正确的是
A.阴极反应式为: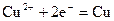 ,当有
,当有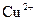 存在时
存在时 不放电
不放电
B.阴极上首先析出铁,然后析出铜
C.阴极上不可能析出铜
D.首先被电解的是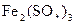 和
和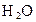 ,后被电解的是
,后被电解的是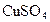 和
和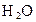
参考答案:D
本题解析:略
本题难度:一般
4、选择题 近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为:KI+H2O→KIO3+H2↑.下列有关说法中,正确的是( )
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
参考答案:A、反应式为:KI+H2O→KIO3+H2↑,阳极是惰性电极
本题解析:
本题难度:一般
5、选择题 早在1807年化学家戴维用电解熔融氢氧化钠制得钠: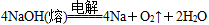 ;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠:
;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠: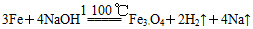 。下列有关说法正确的是
。下列有关说法正确的是

A.电解熔融氢氧化钠制钠,阳极发生电解反应为2OH--2e-=H2↑+O2↑
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数不同
D.目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极
参考答案:C
本题解析:电解熔融NaOH电极反应式为:阴极:4Na++4e-=4Na,阳极:4OH--4e-=O2↑+2H2O,A错误;B项钠的还原性大于铁;若铁作阳极,则铁被电解,D错误;C项,电解熔融NaOH若制得4 mol Na,则转移4 mol e-,盖·吕萨克法制得4 mol Na,则转移8 mol e-。
本题难度:一般