微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.溶度积常数大者,溶解度也大
B.由于AgCl水溶液导电性很弱,所以它是弱电解质
C.难溶电解质离子浓度的乘积就是该物质的溶度积常数
D.难溶电解质的溶度积常数与温度有关
参考答案:A、因同一类型的沉淀,溶度积常数大者,溶解度也大,不同类型的
本题解析:
本题难度:简单
2、选择题 用0.1mol·L-1 AgNO3溶液分别滴定20.00mL浓度均为 0.1mol·L-1 Cl-、Br-、I-溶液,以滴入的AgNO3溶液体积为横坐标, pX为纵坐标[pX=-lgc(X-),X=Cl-、Br-、I-],可绘得下图滴定曲线。已知25℃时:
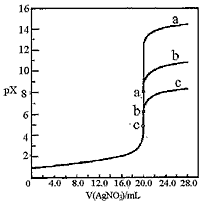

有关说法不正确的是 [???? ]
A.用硝酸银滴定法测定试样中c(Cl-),可滴加0.1mol·L-1 K2CrO4 溶液1~2滴作指示剂
B.a、b、c依次分别表示Cl-、Br-及I-
C.向NaCl和NaBr的混合溶液中滴加硝酸银溶液, 当两种沉淀共存时,c (Br-)/c(Cl-) =2.7×10-3
D.若用硝酸银溶液滴定NaI溶液,当pX=13时, 溶液中c (Ag+)≈0.64×10-17
参考答案:BD
本题解析:
本题难度:一般
3、填空题 七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1?部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Mg(OH)2
|
pH值
| 5.2
| 3.2
| 9.7
| 10.4
| 11.2
?
表2?两种盐的溶解度(单位为g/100g水)
温度/℃
| 10
| 30
| 40
| 50
| 60
| CaSO4
| 0.19
| 0.21
| 0.21
| 0.20
| 0.19
| MgSO4·7H2O
| 30.9
| 35.5
| 40.8
| 45.6
| /
?
硼镁泥制取七水硫酸镁的工艺流程如下:
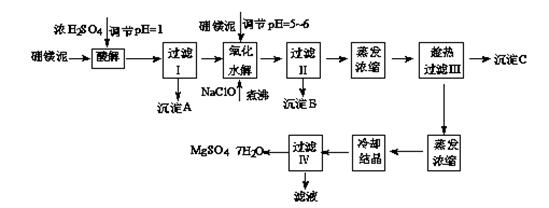
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为????????????????????。加热煮沸的主要目的是?????????????????????????。
(2)沉淀B中除MnO2、SiO2外还含有???????????(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是???????????????????????????;
(4)沉淀C的化学式是???????。过滤III需趁热过滤的理由是???????????????
参考答案:(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-
本题解析:
试题解析:(1)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,盐类的水解为吸热反应,加热有利于Al3+、Fe3+水解以及Mn2+氧化成MnO2,故答案为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;促进Al3+、Fe3+水解及Mn2+氧化成MnO2;(2)根据表中数据可知,在调节溶液的PH在5~6时,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,故答案为:Fe(OH)3、Al(OH)
本题难度:一般
4、选择题 已知某氢氧化物 的溶度积常数为 的溶度积常数为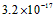 ,则 ,则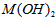 在水中的溶解度为[???? ] 在水中的溶解度为[???? ]
A.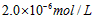
B.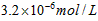
C.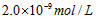
D.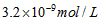
参考答案:A
本题解析:
本题难度:一般
5、选择题 将足量的AgI 分别放入下列物质中,AgI 的溶解度由大到小的排列顺序是??[???? ]
①5mL0.001mol·L-1KI溶液
②15mL0.002mol·L-1CaI2
③35mL0.003mol·L-1HI溶液
④15mL蒸馏水
⑤45mL0.005mol·L-1AgNO3
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
参考答案:B
本题解析:
本题难度:一般
|
|